Diagnostyka
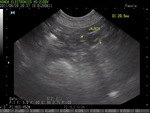
Rozpoznanie ORS u suk w fazie pęcherzykowej nie powinno nastręczać większych problemów. Charakterystyczne dla proestrus zachowanie będące wynikiem podwyższonego stężenia estrogenów, zmiany w obrazie cytologicznym wymazu z pochwy oraz badanie waginoskopowe jednoznacznie wskazują na aktywność wydzielniczą tkanki jajnikowej. W ustaleniu prawidłowego rozpoznania pomocne jest badanie sonograficzne, które najlepiej jest wykonywać w fazie estrus lub proestrus, gdyż wówczas widoczne są pęcherzyki albo torbiele, a pozostawiony fragment jajnika zwiększa swoje rozmiary. W obrazie USG charakterystyczne dla ORS jest rozpulchnienie okolicy kikuta jajnika oraz konglomerat torbielowaty wielkości od kilku milimetrów do nawet 2-3 cm, któremu często towarzyszy zgrubienie i rozpulchnienie błony śluzowej kikuta macicy. Według różnych autorów rozpoznanie ORS w badaniu ultrasonograficznym było potwierdzone badaniem histopatologicznym wycinków po laparotomii odpowiednio w 5 na 10 przypadków i 9 na 12 przypadków. U kobiet czułość tej metody wynosi ok. 93%, ale większość pacjentek przed badaniem zostaje poddana stymulacji hormonalnej w celu uzyskania torbieli jajnikowych, co ułatwia znalezienie fragmentów jajnika (4, 5).
Za wyniki fałszywie dodatnie w badaniu USG odpowiada obecność tkanki ziarninowej w miejscu podwiązania krezki jajnika. Zapalenie i towarzyszący mu obrzęk tkanek kikuta jajnika może utrzymywać się przez dłuższy czas, w zależności od rodzaju materiału użytego do podwiązania. Większość nici rozpuszczalnych ulega wchłonięciu po 3 miesiącach, w niektórych przypadkach jednak fragmenty nici znajdowano nawet powyżej 15 miesięcy od zabiegu (4).
W przypadkach diagnostycznie wątpliwych, jak i w potwierdzonych wykonuje się laparotomię diagnostyczną. W trakcie zabiegu chirurg szuka tkanki jajnikowej, podejrzaną tkankę usuwa i kieruje do oceny histopatologicznej. W tym miejscu należy zaznaczyć, że makroskopowo także trudno jest wyodrębnić pozostawioną tkankę jajnikową, jeśli nie występują w niej cysty widoczne gołym okiem. W badaniach histopatologicznych wycinków pozostawionego jajnika stwierdzano zróżnicowaną tkankę jajnikową, torbiele pęcherzykowe, ciałka żółte, torbiele wywodzące się z ciałek żółtych, cysty okołojajnikowe, a także zmiany o charakterze nowotworowym. Nowotworami najczęściej rozpoznawanymi w pozostawionej tkance jajnikowej są guzy wywodzące się ze sznurów płciowych, a także guz z komórek warstwy ziarnistej jajnika (zona granulosa cell tumor), rzadziej notuje się nowotwory wywodzące się z tkanki nabłonkowej (gruczolaki, gruczolakoraki). U suk z nowotworami jajnika stwierdzano dłuższy okres między zabiegiem kastracji a wystąpieniem objawów rui.
W literaturze można znaleźć opisy przypadków odnajdywania czynnej tkanki jajnikowej pod błoną surowiczą żołądka lub torebką śledziony zarówno u suk, jak i kotek. Przypadki te były wynikiem pewnej mody panującej jeszcze kilkanaście lat temu, polegającej na wszczepianiu fragmentów jajnika w ww. miejsca w celu pozostawienia źródła estrogenów. Z punktu widzenia dzisiejszej wiedzy praktyki takie nie mają sensu, gdyż badania naukowe potwierdziły, że brak wpływu estrogenów i progesteronu na organizmy suk prawidłowo wykastrowanych jest główną przyczyną ich dłuższego życia.
W przypadkach gdy badanie kliniczne i diagnostyka obrazowa nie dają jednoznacznej odpowiedzi, czy w organizmie samicy pozostawiono tkankę jajnikową, wykonujemy testy hormonalne.
U kotek, u których objawy zewnętrzne rujki nie są tak dobrze wyrażone jak u suk, a jajniki mniejsze i trudniej obrazowane w badaniu USG, oznaczanie stężenia hormonów może mieć większe znaczenie.
Samice z ORS podczas fazy pęcherzykowej wykazują podwyższone stężenie estrogenów (nawet do > 20 pg/ml) (5), wydzielanych przez komórki ziarniste dojrzewających pęcherzyków. Podczas luteinizacji komórek warstwy ziarnistej (faza proestrus), owulacji oraz fazy lutealnej koncentracja progesteronu (P4) we krwi wzrasta (do > 2 ng/ml) (5), udowadniając tym samym istnienie przetrwałej tkanki jajnika. Niestety u pacjentek z ORS w fazie anoestrus stężenia estrogenów oraz P4 są na podobnie niskim poziomie i nie mogą stanowić podstawy do postawienia diagnozy.
W tej sytuacji pomocna w rozpoznaniu ORS może być stymulacja z użyciem hormonu GnRH, oddziałującego na oś przysadka–jajnik. Wykonuje się dożylną iniekcję 10 µg/kg m.c. GnRH i cztery pobrania krwi – tuż przed podaniem, 10, 60 i 120 minut później (6). Jeżeli dojdzie do wzrostu stężenia hormonów jajnikowych we krwi, jest to dowód na istnienie aktywnej tkanki jajnika. W badaniu wykorzystywany jest najczęściej estradiol, którego stężenie w większości przypadków ORS wzrasta po 60 minutach ponaddwukrotnie (badając jedynie estradiol, można wykonać dwa pobrania krwi – 0 i 60 minut po iniekcji). Wykorzystując to zjawisko, można odróżnić sukę z ORS od suki, u której nie ma żadnych pozostałości jajnika. U suk w anoestrus reakcja na podanie GnRH jest zbliżona, jeśli badanie opiera się na pomiarze estradiolu. Jeżeli w omawianej metodzie zostanie dokonany pomiar stężenia LH, w czasie iniekcji GnRH i po 10 minutach wyraźnie zarysuje się różnica pomiędzy samicami po zabiegu owariohisterektomii oraz w anoestrus a sukami z zespołem przetrwałego jajnika (badając jedynie LH, można więc wykonać dwa pobrania krwi: 0 i 10 minut po iniekcji). Reakcja na stymulację GnRH jest znacznie silniejsza u suk po owariektomii (wzrost LH nawet do 60-70 µg/l) oraz niekastrowanych będących w fazie anoestrus (wzrost LH do 50-60 µg/l) niż u suk z ORS (wzrost LH do 20 µg/l) (6).
Metoda ta może być jednak zawodna w przypadku istnienia torbieli w przetrwałej tkance jajnika. Efekt testu z użyciem GnRH w takich przypadkach nie jest do końca poznany (7).
W fazie anoestrus różnica w statusie hormonalnym między sukami po zabiegu owariohisterektomii a sukami z ORS jest widoczna w stężeniu gonadotropin. Gonadotropiny we krwi suk po zabiegu owariohisterektomii osiągają zdecydowanie wyższe stężenia z powodu zniesienia hamowania zwrotnego przez hormony wydzielane przez jajnik.
Postępowanie
Usunięcie pozostawionej tkanki jest zabiegiem trudniejszym od standardowej kastracji. Już samo cięcie przez lub w pobliżu blizny po poprzedniej laparotomii powoduje obfite krwawienie. Linia cięcia powinna być na tyle długa, by można było swobodnie zrewidować okolice obydwu tylnych biegunów nerek, co niejednokrotnie wiąże się z przedłużeniem cięcia dogłowowo za pępek. Znalezienie pozostawionego jajnika utrudniają zrosty w jamie otrzewnej. Sama tkanka jajnikowa często bywa zrośnięta z siecią, błoną surowiczą jelit, a po stronie prawej spotyka się nawet zrosty z dwunastnicą i trzustką. Dlatego zabieg powinien być wykonywany przez doświadczonego operatora i raczej nie przez tego, który fragment jajnika pozostawił.
Pomocne w znalezieniu kikuta jajnika są fragmenty więzadeł szerokiego i pobocznego macicy, po których można „dojść” do okolicy miejsca fizjologicznego występowania jajnika. Szczególną ostrożność należy zachować podczas zakładania podwiązki na naczynia jajnikowe z uwagi na bliskość przebiegu moczowodu i brak wyraźnej granicy między tkanką bliznowatą a jajnikową. Znane są w literaturze przypadki omyłkowego podwiązania moczowodu podczas operacji usuwania pozostawionych jajników.
W przypadku zwierząt starszych, zwłaszcza po amputacji macicy, można zaproponować właścicielowi leczenie farmakologiczne. Stosuje się progestageny, głównie w formie długo działających iniekcji powtarzanych co 6 miesięcy. Jednakże skutki uboczne w postaci indukcji zmian nowotworowych w gruczole mlekowym, cukrzycy, nadczynności kory nadnerczy, otyłości czy dermatoz ograniczają długotrwałe stosowanie leków z tej grupy. Mniej ryzykowne wydaje się zastosowanie wprowadzonych ostatnio do praktyki weterynaryjnej małych zwierząt analogów GnRH w postaci podskórnych implantów, które mogą stać się alternatywą dla leczenia chirurgicznego ORS. Nie są jednak jeszcze poznane długotrwałe skutki stosowania analogów GnRH na organizm suk i kotek, dlatego przydatność ich długiego stosowania u samic z pozostawioną tkanką jajnikową jest nadal dyskusyjna.














