Poród jest zakończeniem pełnoterminowej ciąży, podczas której płody dojrzewają do życia poza organizmem matki. U suk i kotek następuje on zwykle między 58. a 68. dniem po pokryciu, chociaż niekiedy bywają porody wcześniejsze lub późniejsze. Zarówno porody przedwczesne, związane z niedojrzałością noworodków, jak i nadmiernie się opóźniające podnoszą ryzyko strat okołoporodowych. Ponadto w przebiegu porodu mogą wystąpić trudności (dystocia – trudny poród) wymagające udzielenia pomocy położniczej. Wśród przeszkód porodowych wyróżnia się przeszkody pochodzące ze strony matki i ze strony płodu; czasem występują one łącznie. Znaczna część problemów może być rozwiązana metodami zachowawczymi, między innymi postępowaniem farmakologicznym.
Summary
Pharmacological management of parturition in small animals
Starting around mid-pregnancy, the blood progesterone concentration drops gradually to reach the lowest values immediately before parturition. This enables softening and dilation of the cervix and makes the myometrium susceptible to contractive factors. PGF2alpha is important as a luteolytic agent and is also involved in the initiation of parturition. Ionic calcium is necessary for adequate uterine contractions in response to oxytocin, which is the chief stimulant of uterine muscle activity. The induction of parturition is the medical termination of pregnancy after full fetal maturation. Glucocorticoids, anti-prolactin ergo derivatives, PGF2alpha analogs or aglepristone are used for this purpose. Aglepristone currently seems to be the drug of choice, because of high efficacy and minor or no side effects. For pharmacological treatment of dystocia, uterorelaxants and uterotonics are available. Under specific conditions, single or repeated injections of low-dose oxytocin are recommended. 10% calcium gluconate may be used additionally or alone in bitches and cautiously in queens.
Key words: dog, cat, induction of parturition, dystocia
Mechanizmy regulacyjne w okresie okołoporodowym

Od połowy ciąży stężenie progesteronu (P4) stopniowo obniża się i tuż przed porodem spada do wartości podstawowych. W wyniku tego powstają warunki do zwiotczenia i rozwarcia się szyjki macicy oraz wrażliwości myometrium na czynniki kurczące. Mierzone co 3 godziny stężenie P4 we krwi wynosiło w czasie 48, 24, 12 i 3 godzin przed porodem odpowiednio: 2,8, 2,2, 1,0 i 0,7 ng/ml (4). Spadek poniżej 2 ng/ml wiąże się u większości suk z obniżeniem się temperatury ciała. Ten charakterystyczny spadek rektalnej temperatury o 0,5-1°C jest w praktyce położniczej wykorzystywany jako wyraźny objaw zwiastunowy porodu. Czynnikiem luteolitycznym, który powoduje zanikanie ciałek żółtych i przez to zanikanie wydzielania przez nie P4, jest prostaglandyna F2α (ryc. 1). Jej rolę jako jednego z czynników inicjujących poród u suk potwierdzono eksperymentalnie (25). Wyrzut prostaglandyny może być odpowiedzią – podobnie jak u innych zwierząt – na wzrost stężenia kortyzolu (10, 22). Stężenie PGF2α we krwi wzrasta jednocześnie z luteolizą i osiąga najwyższą wartość wraz z pojawieniem się pierwszych widocznych objawów porodu (11). Ten przedporodowy wzrost stężenia PGF2α wynika ze wzmożonej aktywności cyklooksygenazy-2 (COX-2) w komórkach trofoblastu, przy czym spadek stężenia P4 wydaje się czynnikiem sygnalnym, a komórki doczesnej (decidua) odgrywają kluczową rolę w międzykomórkowej wymianie informacji (cell-to-cell cross-talk) (13).
U suk z trudnym porodem (pierwotny bezwład macicy) stężenie metabolitów prostaglandyny F2α (PGFM) wynoszące 23 ± 13 nmol/l było istotnie niższe niż u zwierząt kontrolnych (76 ± 23 nmol/l), podczas gdy stężenie P4 wykazywało tendencję odwrotną (3).
Podczas porodu, zwłaszcza w fazie wypierania płodów, występują skurcze mięśni macicy, które są wywoływane oksytocyną. Jest to neurohormon o budowie nonapeptydu wydzielany w podwzgórzu, głównie w jądrze przykomorowym (nucleus paraventricularis) oraz w niewielkich ilościach w jądrze nadwzrokowym (nucleus supraopticus). Przez układ wrotny przysadki oksytocyna jest doprowadzana do części nerwowej (tylnego płata) przysadki, gdzie jest magazynowana i następnie uwalniana, między innymi na potrzeby akcji porodowej. Progesteron hamuje wydzielanie oksytocyny, podczas gdy estrogeny je wzmagają. Oksytocyna, jak każdy hormon, działa w narządach docelowych tylko wówczas, gdy są one wyposażone w swoiste receptory, z którymi może się wiązać. Stężenie receptorów oksytocynowych w macicy wzrasta wraz z zaawansowaniem ciąży.
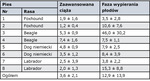
Podczas ciąży stężenie oksytocyny we krwi wynosi średnio 3,6 ± 2,1 pg/ml (zakres od 1,2 do 7,4 pg/ml), a w fazie wypierania płodów znacznie wzrasta, wynosząc średnio 12,9 ± 13,9 pg/ml. Występuje też duże indywidualne zróżnicowanie, gdyż szczytowe wartości osobnicze zawierają się między 10 i 117 pg/ml (12). Przykłady dotyczące różnych suk przedstawia tab. I.
Wapń jest jednym z głównych składników mineralnych organizmu. Około 99% zasobów wapnia znajduje się w kościach, reszta zaś głównie we krwi. Mniej więcej połowa wapnia krążącego we krwi występuje w formie zjonizowanej (wapń zjonizowany) i jest aktywna metabolicznie, podczas gdy pozostała część (wapń związany, przede wszystkim z białkami) pozostaje nieaktywna. W praktyce najczęściej oznacza się całkowite stężenie wapnia we krwi (wapń całkowity), tzn. stężenie zarówno wapnia aktywnego (zjonizowanego), jak i nieaktywnego (związanego). Oznaczenie wapnia zjonizowanego powinno nastąpić w ciągu 15 minut od pobrania krwi. Jeżeli to jest niemożliwe, dopuszcza się przechowywanie krwi w lodówce do godziny.
W okresie okołoporodowym wzrasta zapotrzebowanie na wapń w związku z kostnieniem szkieletów płodów, zapoczątkowaniem laktacji oraz wzrostem aktywności błony mięśniowej macicy. Wapń jest pierwiastkiem biorącym udział w przenoszeniu bodźców nerwowych i powstawaniu potencjałów czynnościowych, warunkując prawidłową czynność rozkurczowo-skurczową mięśni poprzecznie prążkowanych i gładkich. W okresie okołoporodowym jony wapnia odgrywają ważną rolę między innymi w kurczliwości mięśniówki macicy. Jest ona związana z impulsywnymi zmianami potencjału błony komórkowej (potencjał czynnościowy). Dochodzi przy tym do wnikania jonów wapniowych do wnętrza komórki i wzrostu ich stężenia. Jony te łączą się z białkiem kalmoduliną. Kompleks wapń–kalmodulina uruchamia reakcje enzymatyczne prowadzące w konsekwencji do skurczu mięśnia. Przy niedoborze wapnia ten proces jest zaburzony.
Indukcja porodu
Polega na farmakologicznej inicjacji porodu w celu zakończenia ciąży. Wskazaniami do takiego postępowania mogą być ciężkie choroby matki związane z ciążą lub przedłużająca się ciąża. Trwają nieustające poszukiwania metody skutecznej, bezpiecznej i pozbawionej działań ubocznych.
U ssaków wydzielanie kortykosteroidów przez nadnercza płodów i ich przenikanie przez łożysko do krążenia matki stanowi biochemiczny sygnał dojrzałości porodowej płodów i jeden z istotnych elementów inicjujących poród. Podawanie egzogennych glikokortykoidów w drugiej połowie ciąży może, zależnie od jej zaawansowania, doprowadzić do poronienia lub porodu (24).
Antyluteotropowe działanie inhibitorów prolaktyny wykorzystuje się u suk do przerywania ciąży w jej drugiej połowie. Powodują one spadek stężenia prolaktyny, a także progesteronu poniżej wartości koniecznej do utrzymania ciąży. Inhibitory prolaktyny, podobnie jak inne środki poronne, mogą mieć też zastosowanie w indukowaniu porodu.
Po 56. dniu ciąży można indukować poród za pomocą PGF2α, co jednak wiąże się z występowaniem niepożądanych objawów ubocznych (drgawki, ślinienie, wymioty, przyspieszenie oddechu i inne) proporcjonalnie do zastosowanej dawki (15). U suk rasy beagle wywołano poród iniekcją 5 µg/kg fenoprostalenu w dawce jednorazowej lub podzielonej na dwie części podane w odstępie godziny (19). W celu minimalizacji objawów ubocznych podjęto próby wywołania porodu za pomocą długotrwałego podawania niskich dawek analogu prostaglandyny. Skutecznie indukowano porody u 4 suk (o średniej masie ciała ok. 30 kg) za pomocą ciągłej aplikacji analogu PGF2α – kloprostenolu – przy użyciu podskórnie wprowadzonej minipompy uwalniającej substancję w dawce 3,5 µg/kg/dzień. Porody rozpoczęły się po 31,5-57 godzinach. U trzech suk konieczne okazało się stymulowanie opóźniającej się akcji porodowej przy użyciu infuzji soli wapnia i wielokrotnych iniekcji oksytocyny (25). Podobne wyniki otrzymano przy zastosowaniu jeszcze niższej dawki, a mianowicie 1 µg/kg/dobę (18).

Współcześnie środkiem z wyboru wydaje się aglepriston. Blokując receptory progesteronowe, umożliwia, pomimo obecności krążącego progesteronu, rozpoczęcie akcji porodowej. Baan i wsp. (1) nie stwierdzili statystycznie istotnych różnic w przebiegu porodów indukowanych i spontanicznych. Pewne różnice wykazano w zachowaniu się PGF2α. Stężenie PGFM wzrosło w obu grupach przed porodem, osiągając jednak niższy poziom w grupie suk z porodem indukowanym. Po osiągnięciu najwyższych wartości podczas porodu spadało szybko u suk rodzących spontanicznie, utrzymując się na podwyższonym poziomie po porodach indukowanych (2).
Aglepriston nie wywiera bezpośredniego wpływu na błonę mięśniową macicy, a tylko uwrażliwia ją na działanie naturalnych czynników kurczących, dlatego może być niezbędne dodatkowe stosowanie wspomagających leków w celu kontynuacji porodu lub też zastosowanie innych form pomocy porodowej. U 10 suk rasy beagle indukowano poród iniekcją aglepristonu w dawce 15 mg/kg. Następnie dodatkowo podano po 24 godzinach i kontynuowano w odstępach 2-godzinnych aż do wyparcia ostatniego płodu leki kurczące macicę – u 5 suk analog prostaglandyny F2α – alfaprostol w dawce 0,08 mg/kg (grupa 1), u pozostałych 5 zaś oksytocynę w dawce 0,15 j.m./kg (grupa 2). Poród wystąpił u wszystkich zwierząt, rozpoczynając się średnio po 32 godzinach od iniekcji aglepristonu. Całkowity czas wypierania płodów oraz odstępy pomiędzy poszczególnymi szczeniętami były o połowę krótsze w grupie 2, wynosząc odpowiednio 4,5 i 0,8 godz., w porównaniu z 9,1 i 1,7 godz. w grupie 1 (8).

















