Giardioza jest pierwotniaczą chorobą ludzi i zwierząt, powodowaną przez inwazję Giardia intestinalis. Na rynku weterynaryjnym dostępnych jest kilka testów diagnostycznych do rozpoznawania inwazji u psów i kotów. Każdy z tych testów może dawać wyniki fałszywie dodatnie, co jest determinowane przez ich swoistość. Ponadto prawdopodobieństwo, że uzyskany wynik dodatni jest wynikiem prawdziwym, determinowane jest przez wartość predykcji wyniku dodatniego danego testu. W niniejszym artykule autorzy przedstawili testy dostępne w diagnostyce komercyjnej inwazji u psów i kotów oraz omówili sytuacje, w których wyniki tych testów mogą być fałszywie dodatnie.
Summary
Problems with the diagnosis of Giardia intestinalis infection in dogs and cats – false positive results
Giardiasis is a protozoan disease of humans and animals caused by Giardia intestinalis infection. Several diagnostic tests used in dogs and cats are available on the veterinary market. Each of these tests can give false positive results as determined by the specificity of these tests. Moreover, the probability that a positive result is a true positive is determined by the positive predictive value of the test. In this article the authors describe the commercially available tests used in dogs and cats and describe situations in which the results of these tests may be false positive.
Key words: feline and canine giardiasis, false positive diagnosis, specificity, positive predictive value
Wstęp
Inwazja powodowana przez pierwotniaki Giardia intestinalis (ryc. 1) (syn. Giardia duodenalis) może prowadzić do rozwoju choroby określanej terminem giardioza. Głównym objawem choroby jest biegunka. Żywicielami pasożyta mogą być ludzie i zwierzęta, w tym również psy i koty. Ponadto inwazję stwierdzano u małp, przeżuwaczy, świń oraz gryzoni (1, 2, 3). Do zarażenia dochodzi drogą pokarmową w wyniku wprowadzenia doustnie inwazyjnych cyst pierwotniaka. Głównym źródłem zarażenia jest woda zanieczyszczona cystami, źródłem inwazji może być jednak również żywność zanieczyszczona cystami, a w szczególności surowe warzywa. Ponadto inwazja może być przenoszona przez kontakt bezpośredni pomiędzy ludźmi oraz zwierzętami (4, 5). W przypadku zwierząt w rozprzestrzenianiu się inwazji znaczącą rolę odgrywa także gleba zanieczyszczona odchodami zarażonych osobników (2). Po dostaniu się do żołądka z cyst pod wpływem kwasu solnego wydostają się ekscyzoity, z których następnie po podziale komórkowym powstają potomne trofozoity, będące stadium pasożyta zasiedlającym dwunastnicę oraz początkowy odcinek jelita czczego. Za pomocą tarczy przyssawkowej (struktury na powierzchni trofozoitu, przypominającej przyssawkę) trofozoity przylegają do komórek nabłonkowych jelita cienkiego. Trofozoity dzielą się na trofozoity potomne, zasiedlające coraz większą powierzchnię błony śluzowej jelita. Okresowo część trofozoitów potomnych formuje cysty, które wraz z kałem są wydalane do środowiska zewnętrznego (2, 6). Okres prepatentny inwazji u psów wynosi od 5 do 12 dni, natomiast u kotów mieści się w przedziale od 5 do 16 dni. Cysty pasożyta w środowisku zewnętrznym przeżywają od kilku dni do kilku tygodni w wilgotnych miejscach (3).
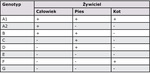
Gatunek G. intestinalis dzieli się na kilka genotypów (grup Mayrhofera) oznaczanych literami A–G. Genotypy występujące u ludzi oraz psów i kotów przedstawiono w tab. I. Sporadycznie wykrywano również u psów i kotów genotyp A2 oraz u kotów genotypy B i D (7, 8, 9). W przypadku ludzi zarażenia najczęściej obserwowane są u dzieci, co może wskazywać z jednej strony na rolę statusu immunologicznego w rozwoju inwazji, z drugiej zaś na rolę zachowań higienicznych w jej rozprzestrzenianiu (10).
Ze względu na fakt, że psy i koty mogą stanowić źródło inwazji dla człowieka, niezwykle ważne jest jej rozpoznanie. W komercyjnej diagnostyce giardiozy wykorzystywanych jest kilka technik. W przypadku każdej z nich mogą się pojawić wyniki fałszywe. W niniejszej pracy autorzy pokrótce przedstawili sytuacje, w których może dochodzić do fałszywego rozpoznania inwazji. Częstotliwość występowania wyników fałszywie dodatnich w przypadku różnych technik diagnostycznych jest determinowana przez swoistość testu, natomiast prawdopodobieństwo, że wynik dodatni jest prawdziwy, określa tzw. wartość predykcji, która jest zależna również od ekstensywności inwazji w danej populacji. Wartości predykcji zarówno wyniku dodatniego, jak i ujemnego są wyrażane procentowo lub w postaci ułamka dziesiętnego. Prawdopodobieństwo uzyskania wyniku prawdziwie dodatniego lub prawdziwie ujemnego wzrasta wraz z wartością predykcji. Warto również wspomnieć, że ten sam test może mieć różną czułość i swoistość w zależności od tego, jaki inny test został uznany za tzw. złoty standard, w odniesieniu do którego obliczana była czułość i swoistość tego testu (11). W diagnostyce inwazji powodowanej przez G. intestinalis za złoty standard uznaje się obecnie test immunofluorescencji pośredniej. Za pomocą przeciwciał monoklonalnych znakowanych fluoresceiną wykrywa on w kale cysty pasożyta. Uwidocznienie cyst jest możliwe w mikroskopie fluorescencyjnym, w którym po wzbudzeniu światłem o określonej długości fali fluoresceina emituje barwę zieloną. Test ten charakteryzuje się bardzo wysoką czułością i swoistością, dzięki czemu uzyskuje się znikomy odsetek wyników fałszywych (3, 12).
Najczęściej stosowanymi testami w komercyjnej laboratoryjnej diagnostyce giardiozy u psów i kotów są: badanie mikroskopowe, PCR, ELISA oraz test immunochromatograficzny. Stosowanie innych, nowocześniejszych technik diagnostycznych jest obecnie ograniczone do badań naukowych ze względu na zbyt wysokie koszty.
Badanie mikroskopowe
Przeprowadzane przy użyciu mikroskopu świetlnego badanie w kierunku inwazji G. intestinalis należy do najtańszych badań diagnostycznych. Wynik tego badania zależy jednak w znacznym stopniu od czynników subiektywnych, związanych z osobą wykonującą to badanie, a co za tym idzie, nie jest możliwe określenie swoistości tego badania jako testu diagnostycznego. Zarówno czułość, jak i swoistość w przypadku badania mikroskopowego zmieniają się w zależności od wiedzy, doświadczenia, umiejętności oraz dokładności laboranta (13). Warto jednak wspomnieć, że uzyskanie wiarygodnego wyniku ujemnego jest możliwe dopiero w przypadku zbadania trzech próbek kału pobranych w ciągu 5-7 dni, co wynika z faktu, że cysty G. intestinalis są wydalane nieregularnie i w zmiennych ilościach (14).
Występowanie wyników fałszywie dodatnich w przypadku badania mikroskopowego jest związane głównie z doświadczeniem i wiedzą osoby wykonującej badanie. W badaniu mikroskopowym poza cystami bądź trofozoitami G. intestinalis można również stwierdzić obecność innych pasożytów lub drożdżaków, co jest niewątpliwą zaletą tego badania. Jednakże mało doświadczony laborant może błędnie rozpoznać jako cysty G. intestinalis drożdżaki, trofozoity rzęsistków Tritrichomonas foetus albo uwolnione z oocyst sporocysty pierwotniaków z rodzaju Sarcocystis (14, 15, 16). Pomyłek związanych z nieprawidłowym rozpoznaniem z pewnością może być więcej. Należy pamiętać, że w badanym preparacie obecne są również elementy roślinne (np. pyłki roślinne), krople tłuszczu, zarodniki pleśni czy różnego rodzaju komórki żywiciela pochodzące z przewodu pokarmowego (14). Zajac i Conboy (14) podają skrajny przykład nieprawidłowego rozpoznania, w przypadku którego pęcherzyki powietrza były rozpoznawane jako oocysty kokcydiów. Należy jednak podkreślić, iż istnieje znikome prawdopodobieństwo, że doświadczony parazytolog mylnie rozpozna jeden z artefaktów i wyda wynik fałszywie dodatni.
Ponadto niezwykle ważne jest staranne i dokładne mycie sprzętu laboratoryjnego używanego podczas badań. Brak tej staranności może skutkować zanieczyszczeniem badanych próbek cystami pochodzącymi z próbek badanych wcześniej, czego konsekwencją również mogą być wyniki fałszywie dodatnie. Alternatywnym rozwiązaniem może być używanie jednorazowego sprzętu, prowadzi to jednak do wzrostu kosztów badań. I w tym przypadku jednak niskie jest prawdopodobieństwo, by laborant mający odpowiednią wiedzę i doświadczenie wykonał czynności związane z myciem szkła laboratoryjnego w sposób niestaranny.
Badanie metodą PCR
Badanie kału metodą PCR opartą na starterach komplementarnych do fragmentu jednego z genów G. intestinalis należy do najczulszych metod diagnostycznych stosowanych w weterynaryjnej diagnostyce laboratoryjnej. Ponadto test ten wykazuje bardzo wysoką swoistość – 100% przy 95-procentowym przedziale ufności wynoszącym od 91,3 do 100%. Jednakże czułość tego testu zależy również od rodzaju starterów użytych w badaniu. Nantavisai i wsp. (17) wykazali, że badanie przy użyciu starterów komplementarnych do fragmentu genu małej podjednostki rybosomu pozwala na wykrycie DNA G. intestinalis przy stężeniu 10 pg/µL w mieszaninie reakcyjnej, podczas gdy badanie z zastosowaniem starterów komplementarnych do fragmentu genu izomerazy triozofosforanowej pozwalało na wykrycie DNA pierwotniaka dopiero przy stężeniu DNA przekraczającym 1000 pg/µL.
Badanie metodą PCR należy obecnie do najdroższych metod spośród stosowanych testów komercyjnych, dlatego też test ten znajduje szczególne zastosowanie w sytuacjach gdy koncentracja cyst w badanej próbce jest niewielka i nie udaje się wykryć inwazji za pomocą innych technik (3, 17). W badaniu tym poszukiwany fragment genu pasożyta jest powielany w termocyklerze. Termocykler jest aparatem przystosowanym do szybkich, wielokrotnych zmian temperatury, co pozwala na cykliczne rozdzielanie podwójnej nici DNA, następnie przyłączanie krótkich odcinków DNA komplementarnych do poszukiwanego fragmentu genu, nazywanych starterami, oraz dobudowywanie nowej nici kwasu nukleinowego na matrycy poszukiwanego DNA. W ten sposób uzyskuje się powielony fragment genu pasożyta, który można uwidocznić oraz określić jego długość za pomocą elektroforetycznego rozdziału w żelu agarozowym. Uwidocznienie poszukiwanego fragmentu genu jest możliwe dzięki dodaniu do żelu agarozowego wiążącego się z DNA bromku etydyny, który emituje światło barwy pomarańczowej w świetle UV (18). Warto również podkreślić, że badanie metodą PCR jest jedyną techniką laboratoryjną pozwalającą określić grupę genetyczną G. intestinalis.
Niestety w przypadku badania kału metodą PCR również istnieje ryzyko otrzymania wyników fałszywie dodatnich. Wyniki takie mogą pojawić się w sytuacji uzyskania nieswoistego produktu PCR, mającego tę samą bądź zbliżoną długość do oczekiwanej długości poszukiwanego fragmentu genu pasożyta. Rozwiązaniem tego problemu może być weryfikacja wyniku za pomocą analizy restrykcyjnej bądź sekwencjonowania otrzymanego produktu reakcji, wiąże się to jednak z podniesieniem kosztów tych badań (19, 20, 21).
Jak już wcześniej wspomniano, metoda PCR jest niezwykle czułym testem. Z jednej strony jest to ogromna zaleta tej metody, z drugiej strony jednak niesie ryzyko uzyskania wyników fałszywie dodatnich w wyniku zanieczyszczenia badanych próbek lub odczynników używanych do przygotowania mieszaniny reakcyjnej nawet śladowymi ilościami DNA pasożyta, pochodzącymi z wcześniej wykonywanych badań. Ryzyko to próbuje się obniżyć poprzez używanie zarówno do izolacji DNA z kału, jak i wykonywania samego badania metodą PCR wyłącznie sterylnych jednorazowych probówek i końcówek do pipet. Nadal jednak pozostaje ryzyko zanieczyszczenia odczynników używanych do badania. Obecnie w wielu laboratoriach izolację DNA oraz badanie techniką PCR wykonuje się w oddzielnych pomieszczeniach, przeznaczonych wyłącznie do jednego z tych celów.
W przypadku wykonywania badań metodą PCR niezwykle ważna jest dyscyplina i odpowiednie wyuczone nawyki laboranta. Niedopuszczalne jest używanie niesterylnego sprzętu bądź jego wielokrotne używanie, zapominanie o zmianie końcówek do pipet po każdym pipetowaniu, dotykanie sterylnymi końcówkami do pipet blatu roboczego czy też pozostawianie otwartych odczynników. Zatem wysoka czułość metody PCR powoduje, że niezwykle ważna jest staranność podczas wykonywanych badań, a czynnik ludzki (zmęczenie, rozkojarzenie itp.) może skutkować uzyskaniem wyników fałszywie dodatnich.
















