Wśród grzybic narządowych zwierząt i człowieka coraz ważniejszą rolę zaczyna odgrywać sporotrychoza wywołana przez Sporothrix schenckii complex (S. schenckii sensu stricto, S. globosa, S. brasiliensis, S. luriei). Na tę podostrą lub przewlekłą chorobę oprócz kotów chorują psy, konie, krowy, wielbłądy, kozy, muły, świnie, zwierzęta laboratoryjne, gryzonie, ptaki, delfiny, w tropikach pancerniki. Sporotrychoza kotów stanowi przy tym problem epidemiologiczny ze względu na wysoki potencjał zoonotyczny, przez co zakażone koty stanowią zagrożenie dla zdrowia człowieka (5, 7). Chorobę charakteryzują wieloogniskowe ziarniniakowe zmiany w skórze i tkance podskórnej głowy, uszu i klatce piersiowej oraz zapalenie naczyń i węzłów chłonnych. Sporotrychoza może także dotyczyć kości, ośrodkowego układu nerwowego i narządów wewnętrznych (1).
Epidemiologia
Sporotrychoza występuje we wszystkich krajach. W tropikach i na południu USA występuje endemicznie, natomiast w Europie poza Francją, Włochami, Polską i Wielką Brytanią jest notowana rzadko. Istnieje możliwość zakażenia się człowieka od chorych kotów i psów, dlatego odgrywa pewną rolę jako zoonoza (4). Ze względu na powszechne występowanie w glebie bogatej w substancje organiczne, wodzie, powietrzu, a nawet jamie ustnej zdrowych zwierząt, oraz charakter dymorficzny grzyba (faza mycelialna saprofityczna i faza drożdżowa patogenna) S. schenckii jest dużym zagrożeniem epidemiologicznym. W XXI wieku sporotrychoza w związku z ewolucją S. schenckii oraz zmianami w bioróżnorodności środowiska i jego skażeniem jest uważana w wielu krajach za jedną z najważniejszych zagrażających (emerging) grzybic.
Charakterystyka S. schenckii sensu lato
S. schenckii jest dimorficznym ubikwitarnym grzybem występującym w fazie mycelialnej (saprofitycznej) oraz w fazie drożdżowej (patogennej). W fazie mycelialnej rośnie na agarze Sabourauda z dekstrozą w 25-30°C, w fazie drożdżowej w 37°C. W środowisku rośnie w 22-27°C przy wilgotności 90% i pH 3,5-9,4 (12). Grzybnia jest zbudowana z delikatnych wielokomórkowych strzępek o szerokości około 2 µm, wśród których występują krótkie pojedyncze konidiofory. Cylindryczne lub gruszkowatego kształtu konidia 2-3 × 2-6 µm tworzą na szczycie konidioforów różnego kształtu skupiska. W fazie drożdżowej występują komórki wegetatywne owalne, okrągłe lub wrzecionowate (3-5 µm × 5-9 µm), wytwarzające przez pączkowanie blastospory. Na agarze Sabourauda lub na agarze z krwią w 37°C grzyb wytwarza kremowobiałe, brązowe lub szarawe kolonie, gładkie, lśniące, nieznacznie uwypuklające się nad powierzchnię podłoża wzrostowego. W temperaturze pokojowej kolonie są puszyste, barwy kremowej lub szarej, o nieregularnej, promieniście pofałdowanej powierzchni.
U kotów występują dwie drogi zakażenia przez S. schenckii – przez uszkodzoną skórę i w wyniku ukąszenia owadów oraz rzadziej drogą aerogenną. Zakażenie rozwija się w miejscu wniknięcia zarazka. Z reguły są to zmiany skórne, a następnie zakażenie szerzy się drogą naczyń chłonnych. Niekiedy zarodniki grzyba po przedostaniu się do naczyń krwionośnych są roznoszone z krwią po całym organizmie i wtedy zakażenie może obejmować kości, płuca, wątrobę, śledzionę, żołądek, jelita i ośrodkowy układ nerwowy. Do rozwoju choroby usposabiają pierwotne i wtórne niedobory immunologiczne, dotyczące zwłaszcza odporności komórkowej organizmu.
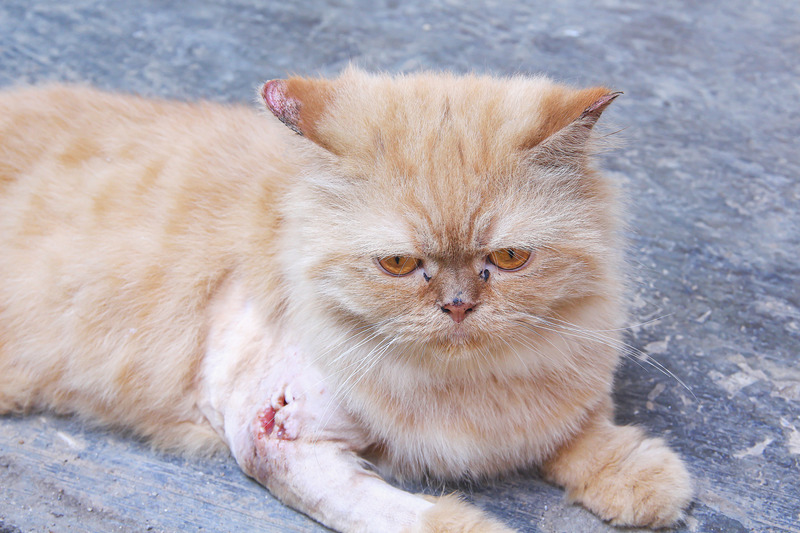
U kotów w związku z obniżoną odpornością wzrasta liczba limfocytów CD8 związanych z aktywnością Th2, wzrasta stężenie IL-10, ziarniniaki tworzą się powoli i S. shenckii namnaża się szybko w zakażonych tkankach (11). Ciężki przebieg sporotrychozy u kotów jest najczęściej związany z zakażeniami retrowirusowymi, które cechują się immunosupresją (2). Duże znaczenie w patogenezie choroby ma wzrost zjadliwości grzyba spowodowany jego większą opornością na stres oksydacyjny organizmu dzięki produkowaniu przez grzyb dysmutazy nadtlenkowej (SOD), mniejszą podatnością na fagocytozę oraz niszczenie przez makrofagi i neutrofile na skutek produkcji melaniny (15). Proteinaza 1 umożliwia zakażenie skóry. Adhezyny, a wśród nich glikoproteina Gp60 obecna w ścianie komórkowej zjadliwych szczepów, ogrywają rolę w łączeniu się grzyba z macierzą skórną i fibronektyną.
Odporność
Na istotną rolę odporności komórkowej w sporotrychozie wskazuje korelacja pomiędzy wzrostem liczby komórek CD4+ i spadkiem liczby zmian chorobowych, nasileniem zapalenia i namnażaniem się grzyba. W rozwoju odporności na zakażenie decydujące znaczenie ma odpowiedź związana z limfocytami Th1/Th17. Produkują one cytokiny – IFN-γ, TNF-α, IL-17A, które aktywują makrofagi i neutrofile do likwidacji zakażenia. IL-17A produkowana przez Th17 bierze udział w reperacji i aktywacji bariery nabłonkowej, a limfocyty Th17 odgrywają kluczową rolę w aktywacji komórek NK (naturalny zabójca). Zakażenie uruchamia też odpowiedź humoralną. Następuje aktywacja dopełniacza na drodze klasycznej i alternatywnej, produkowane są aglutyniny, wzrasta fagocytoza grzyba w związku z działaniem opsonizacyjnym przeciwciał i występuje cytotoksyczność komórkowa związana z przeciwciałami (ADCC). Powstają przeciwciała przeciwko różnym składowym ściany komórkowej grzyba, przy czym najważniejszą rolę w odporności humoralnej odgrywają przeciwciała występujące w klasie IgG1 i IgG2 immunoglobulin przeciwko glikoproteinie ściany komórkowej 60 (Gp60) u S. brasiliensis i 70 (Gp70) u S. schenckii (3, 15).
Objawy kliniczne
Sporotrychoza u kotów ma trzy postacie – skórną (zlokalizowaną), skórno-limfatyczną i rozsianą (układową). Stare samce chorują częściej niż samice. Postać układowa choroby występuje rzadko i jest najczęściej związana z immunosupresją (13). W miejscu wniknięcia spor grzyba przez rany, zadrapania i otarcia w skórze lub tkance podskórnej kończyn piersiowych, bioder, podstawy ucha, grzbietu nosa tworzą się wyłysienia, niebolesne twarde guzki oraz owrzodzenia z wysiękiem surowiczo-krwistym i ropnie. Zmianom na skórze u około 1/3 chorych zwierząt towarzyszy zajęcie górnego odcinka dróg oddechowych w postaci duszności, krwawej wydzieliny śluzowej z nozdrzy i kichania (8). Pojawiają się także objawy ogólne o nieswoistym charakterze, takie jak osowienie, utrata apetytu i gorączka.
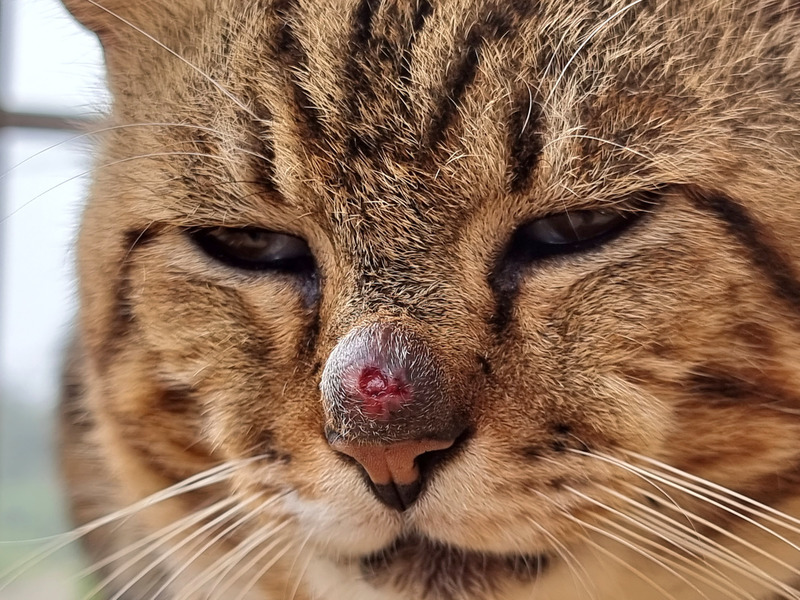
Uogólniona postać skórna choroby jest następstwem zakażenia hematogennego. Natomiast postać skórna rozsiana jest skutkiem samopielęgnacji, która umożliwia przeniesienie zakażenia na inne partie ciała. Z postaci skórnej rozwija się postać skórno-limfatyczna. W jej przebiegu powstają liczne ogniska rozmiękające wzdłuż naczyń chłonnych, którym towarzyszą mało charakterystyczne zmiany w naskórku w postaci wyłysienia, martwica tkanki podskórnej oraz tworzenie brodawek i blizn.
Postać uogólniona sporotrychozy najczęściej dotyczy płuc i wątroby. Ta postać choroby często kończy się śmiercią. Występująca w jej przebiegu niedokrwistość, leukocytoza, neutrofilia, hipergammaglobulinemia i hipoalbuminemia mają charakter nieswoisty i świadczą jedynie o przewlekłym procesie zapalnym toczącym się w organizmie.
Zmiany anatomo- i histopatologiczne
W postaci skórnej stwierdza się obecność przebarwień i wyłysień skóry, ropnych ziarniniaków i owrzodzeń. Ziarniniaki występują w powierzchownych i głębszych warstwach skóry i są zbudowane z makrofagów, neutrofili, w mniejszym stopniu z limfocytów. Cytoplazma makrofagów zawiera liczne formy grzyba kształtu wrzecionowatego, gwiazdkowatego i przypominającego cygaro o średnicy 3-5 × 5-9 µm. W postaci układowej liczne ziarniniaki występują w zajętych chorobą narządach wewnętrznych, a regionalne węzły chłonne są powiększone. W postaci uogólnionej ziarniniaki obecne są w narządach wewnętrznych. Pęcherzyki płucne wypełnia płyn zawierający eozynofile i białko, włosowate naczynia krwionośne pęcherzyków płucnych są rozszerzone. Ziarniniaki i postacie drożdżowe grzyba występują w płucach, wątrobie, węzłach chłonnych, nerkach i nadnerczach. Gremiao i wsp. stwierdzili ropno-ziarniniakowy naciek zapalny w skórze właściwej u 94,1% chorych kotów, w tkance podskórnej u 82,4%, w przylegających do zmian mięśniach szkieletowych u 64,7%, w kościach u 41,2%, w szpiku kostnym u 58,8%, w chrząstce hialinowej przedsionka nosa u 23,5%, w śluzówce układu oddechowego u 52,9% i w śluzówce zatok przynosowych u 41,2% (8).
Rozpoznanie
W rozpoznaniu wykorzystuje się badania anatomopatologiczne, histopatologiczne, hodowlane, test PCR (10, 14). Czułość testów diagnostycznych jest duża. Czułość badania cytologicznego bioptatów z wykorzystaniem barwienia typu Romanowskiego wynosi 79%, natomiast badań histologicznych z Grocott (GMS) 94%. W celu identyfikacji elementów grzyba stosuje się test immunofluorescencji oraz metodę RT-PCR. W diagnostyce przydatna jest próba biologiczna polegająca na zakażeniu dootrzewnowym chomików, myszy lub szczurów. Po 2-3 tygodniach po zakażeniu w wyniku dodatnim stwierdza się liczne postacie grzyba w preparatach histologicznych sporządzonych z wątroby, śledziony i jąder.















