Niezwykle ważne jest, aby próbki w jak najkrótszym czasie po pobraniu (do dwóch godzin) trafiły do laboratorium. Skład chemiczny PMR sprawia, że w obecnych w nim leukocytach już po godzinie od pobrania zachodzą zmiany uniemożliwiające ich wiarygodną ocenę, ponadto na skutek glikolizy dochodzi do podwyższenia stężenia mleczanów (1, 3). Jeśli próbek nie uda się dostarczyć do laboratorium w odpowiednim czasie, można w celu stabilizacji komórek do jednej z nich dodać 30% objętości surowicy od tego samego pacjenta. Próbka taka, ze względu na zmianę wartości biochemicznych, nie nadaje się do innych badań poza oceną cytologiczną. Innym sposobem jest dodanie jednej kropli 10% formaliny do 1-2 ml płynu. Stabilizuje to komórki na maksymalnie osiem godzin. Część materiału przeznaczoną do badań biochemicznych można zamrozić, natomiast probówkę z materiałem przeznaczonym do badań mikrobiologicznych przechowuje się w temperaturze pokojowej (3, 17).
Bardzo istotne jest, aby wraz z PMR przesłać do laboratorium pełną krew lub surowicę danego zwierzęcia, pobraną do czystej probówki („na skrzep”). Dopiero porównanie poszczególnych parametrów biochemicznych w płynie i w surowicy pozwala na uzyskanie wiarygodnego wyniku.
Badanie płynu mózgowo-rdzeniowego w laboratorium
Jak wspomniano, wszystkie badania PMR powinno się wykonywać natychmiast po jego pobraniu. Opóźnienie badania może być powodem uzyskania błędnych wyników liczby komórek, wynikających z autolizy krwinek białych, lub zawyżonej zawartości mleczanów na skutek glikolizy. W temperaturze pokojowej w ciągu dwóch godzin dochodzi do autolizy 40% leukocytów obecnych w PMR. Schładzanie próbki znacznie spowalnia ten proces – mniej więcej o 15% – ale całkowicie go nie zatrzymuje. Jeżeli więc z jakiejkolwiek przyczyny opóźnia się liczenie komórek w PMR, próbkę trzeba przechowywać w lodówce.
Prawidłowy płyn mózgowo-rdzeniowy jest przejrzysty, bezbarwny, o lepkości zbliżonej do wody (1, 9). Parametry rutynowej oceny płynu mózgowo-rdzeniowego różnią się w zależności od laboratorium. Najszerzej stosowany jest schemat zawierający ocenę tendencji do krzepnięcia, przejrzystości, barwy, krwawienia podpajęczynówkowego, liczby komórek, odsetkowego składu komórek. W badaniu tym określane jest także stężenie białka całkowitego i glukozy. Na życzenie lekarza zlecającego badanie może być poszerzone o określenie stężenia albumin, wyznaczenie współczynnika albuminowego (Q alb), określenie stężenia immunoglobulin, wyznaczenie współczynnika Q IgG, oznaczenie przeciwciał w kierunku czynników zakaźnych, poszukiwanie materiału genetycznego zarazków metodą PCR, posiew mikrobiologiczny z wykonaniem antybiogramu.
Liczba komórek (cytoza lub – przy podwyższonej ich liczbie – pleocytoza) w prawidłowym płynie mózgowo-rdzeniowym jest niewielka, a w tych zakresach liczniki hematologiczne dają wyniki niedokładne (liczba podstawowa jest w tych aparatach wyższa od badanej). Dlatego liczenie komórek w PMR przeprowadza się pod mikroskopem z użyciem hemocytometru (1, 3, 10).
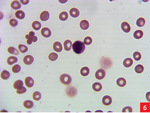
Różnicowanie i liczenie komórek (cytogram) dostarczają użytecznych wskazówek diagnostycznych. Do uzyskania odsetkowej liczby komórek w płynie mózgowo-rdzeniowym konieczne jest zagęszczenie komórek, przygotowanie rozmazu na szkiełku podstawowym oraz zabarwienie preparatu barwnikiem Wrighta lub May-Grunwalda-Giemsy (1, 3).
Płyn mózgowo-rdzeniowy do badania po raz pierwszy pobrał Quincke w 1981 roku. Od tej pory opracowano szereg metod zagęszczania komórek w PMR (10).
Technika wirowania płynu nie zapewnia wyników diagnostycznie wiarygodnych, ponieważ pod wpływem siły odśrodkowej komórki „rozbijają się” o ścianki probówki. W procesie wirowania zniszczeniu ulega najwięcej monocytów i makrofagów, co powoduje względny wzrost liczby limfocytów.
Istotny postęp w przygotowywanie preparatów cytologicznych wniosła metoda samoistnej sedymentacji, polegająca na swobodnym osadzaniu komórek na szkiełku podstawowym (metoda Sayka). Najlepszą metodą jest jednak technika cytowirowania (służąca do zagęszczania komórek). Zapewnia ona dobry odzysk komórek, chroni przed uszkodzeniem oraz jest szybka i łatwa w wykonaniu. Technika ta jest obecnie stosowana najszerzej.
Mimo licznych badań składników chemicznych płynu, udało się ustalić znaczenie diagnostyczne tylko niewielu z nich. Dominują badania stężenia glukozy, mleczanów i różnych białek w płynie mózgowo-rdzeniowym. Oznaczanie powyższych parametrów odbywa się przy użyciu aparatów do badań biochemicznych (np. Cobas integra 400 plus).
Autorki dziękują właścicielom Przychodni Weterynaryjnej „Bokserska” za możliwość wykonania zdjęć.
■
Ryc. 1-6 – M. Cymerman, ryc. 7 – S. Skrzeczyński