Zatrucie mikotoksynami u bydła. Cz. II. Rozpoznawanie i leczenie mikotoksykoz
dr n. wet. Jan Marczuk1
dr hab. Krzysztof Lutnicki1
mgr Teresa Karpińska2
Przy podejrzeniach zatrucia toksynami grzybów u bydła przydatne jest podstawowe badanie hematologiczne i biochemiczne krwi. W celu ostatecznego rozpoznania (potwierdzenia) zatrucia mikotoksynami u bydła wykorzystuje się badanie zawartości mikotoksyn w paszach oraz w surowicy krwi. W profilaktyce i leczeniu mikotoksykoz zaleca się usunięcie zanieczyszczonej paszy z żywienia zwierząt oraz stosuje się dodatki żywieniowe, które absorbują mikotoksyny. Pierwsza część artykułu ukazała się w monografii „Choroby bydła” w 2010 r.
Summary
Mycotoxicoses in dairy cows, part II. Diagnosis and treatment
The method for identifying mycotoxin poisoning in cattle study is based on determination of the content of mycotoxins in feed and in blood serum. The prevention and treatment relies on removing mycotoxin-contaminated fodder from animal nutrition and using food additives that absorb mycotoxins.
Key words: dairy cattle, mycotoxins, laboratory diagnosis
Różnorodne czynniki, takie jak warunki meteorologiczne, uproszczony sposób uprawy roślin, niższe zużycie środków ochrony roślin, sposób przechowywania surowców, są przyczyną wzrostu zawartości toksyn grzybiczych w paszach. Na pasze zanieczyszczone mikotoksynami szczególnie wrażliwe są trzoda chlewna i drób, a w mniejszym stopniu przeżuwacze (7). Wynika to głównie ze specyfiki procesów trawiennych. Oporność zwierząt przeżuwających na mikotoksyny zależy od stopnia ich eliminacji przez mikroorganizmy żwaczowe, zanim będą miały okazję być wchłonięte do organizmu przeżuwacza. Objawy kliniczne towarzyszące zatruciom mikotoksynami są nieswoiste i wynikają z zachwiania równowagi metabolicznej i hormonalnej, stanów zapalnych oraz odpowiedzi immunologicznej. Jednoznaczne zdiagnozowanie określonej mikotoksykozy jest bardzo trudne z racji mnogości patogenów, wielokierunkowego wpływu na organizm, różnorodnych objawów klinicznych i bardzo drogich badań laboratoryjnych. Ważne jest stwierdzenie zanieczyszczenia pasz mikotoksynami. Zatrucie mikotoksynami można podejrzewać w każdym przypadku chorobowym o nietypowym przebiegu, gdzie klasyczne leczenie nie odnosi skutku.
Rozpoznawanie zatrucia mikotoksynami u bydła
Badanie hematologiczne i biochemiczne
Analiza zarówno ostrych, jak i przewlekłych przypadków zatruć mikotoksynami u bydła wykazała znaczną różnorodność wyników badań laboratoryjnych. Wyniki badania hematologicznego czterech przypadków przewlekłego zatrucia mikotoksynami zostały przedstawione w tab. I.
Podobnie jak obraz hematologiczny, również zmiany biochemiczne krwi krów z przewlekłą mikotoksykozą są bardzo zróżnicowane. W badaniach własnych obserwowano uszkodzenie wątroby (wzrost aktywności AST i GGT), zaburzenia gospodarki białkowej (niskie stężenie globulin i wysoki stosunek albuminy/globuliny, wzrost stężenia fibrynogenu, obniżenie stosunku białko całkowite/fibrynogen) (6). Obremski i wsp. w stadzie 60 krów mlecznych z nieswoistymi objawami mikotoksykozy obserwowali uszkodzenie i niewydolność wątroby (wzrost aktywności enzymów AST, ALT, ALP i stężenia bilirubiny) oraz niewydolność nerek (wzrost stężenia mocznika i kreatyniny). Wzrost aktywności ALT u krów z mikotoksykozą przemawia za ciężkim uszkodzeniem wątroby (8).
Jednym z następstw przewlekłego zatrucia mikotoksynami jest immunosupresja wykazywana w badaniach specjalistycznych (4, 5).
W celu postawienia właściwej diagnozy zaleca się badanie zawartości mikotoksyn w surowicy krwi. Nie jest to jednak badanie wykonywane rutynowo, wymaga bowiem specjalistycznej aparatury. Ponadto warto mieć przekonujące dowody na zanieczyszczenie pasz mikotoksynami w postaci zawartości mikotoksyn w paszach. Z tego powodu coraz częściej wykonuje się badanie zawartości mikotoksyn w paszy, które obejmuje zarówno zawartość mikotoksyn w paszach złożonych (wieloskładnikowych), jak i w pojedynczych surowcach paszowych. Należy zaznaczyć, że wynik badania paszy wieloskładnikowej (skład paszy jest złożony) jest mniej miarodajny. Najbardziej miarodajne wyniki otrzymujemy z badania paszy jednorodnej, chociaż wyniki badania mogą różnić się w zależności od miejsca pobrania. Dlatego bardzo ważnym zagadnieniem jest reprezentatywność próbki. Drieihuis i wsp. wykazali, że deoksyniwalenol (DON) występuje w 38-54%, a zearalenon (ZEA) w 17-38% z przebadanych 169 próbek paszy (1).
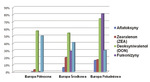
Przy analizie pasz importowanych należy zwrócić szczególną uwagę na ich miejsce pochodzenia (kraj, kontynent). Na różnych kontynentach, jak również na obszarze Europy obserwuje się duże zróżnicowanie co do rodzaju i ilości występowania mikotoksyn. Na ryc. 1 zostały przedstawione mikotoksyny najczęściej występujące w Europie.
Badanie testem ELISA pozwala zarówno na jakościowe, jak i ilościowe stwierdzenie obecności mikotoksyn w paszy. Do oznaczenia zawartości wybranych mikotoksyn w paszach za pomocą testu Elisa wykorzystywana jest procedura immunologiczna oparta na barwnej reakcji enzymatycznej. Zaletą tej metody jest szybkie oznaczenie, wysoka wydajność (88 próbek w ciągu 2 godzin), wyniki należy jednak traktować jako wskaźnikowe. Badanie testem ELISA nie wymaga stosowania bardzo drogiej specjalistycznej aparatury, mankamentem tej metody jest natomiast konieczność zgromadzenia dużej liczby próbek materiału oraz mała swoistość.

Do oznaczania ilościowego mikotoksyn w paszach wykorzystywane są również techniki kinetyczne. Metoda ta polega na określeniu szybkości wiązania antygenu z przeciwciałem. Reakcja przebiega w kuwetach polarymetru fluorescencyjnego, zawierających antygen naturalny (mikotoksyna), określoną ilość przeciwciał oraz określoną ilość antygenu oznaczonego markerem fluorescencyjnym. Metoda ta pozwala na szybkie oznaczenie ilościowe aflatoksyn (Aokin Mycontrol AFLA), ochratoksyny (Aokin mycontrol OTA), zearalenonu (Aokin mycontrol ZEA) i deoksyniwalenolu (Aokin mycontrol DON) w paszy.

Do dokładnego ilościowego oznaczania mikotoksyn w paszach współcześnie wykorzystuje się metody chromatografii cienkowarstwowej (TLC), wysokorozdzielczej chromatografii cienkowarstwowej (HPTLC), chromatografii cieczowej (HPLC) oraz chromatografii gazowej w połączeniu ze spektrofotometrią masową (GC/MS). Ostatnia metoda badawcza jest najbardziej czuła, gdyż pozwala na wykrycie w badanym materiale 30 molekuł mikotoksyn (3, 10).



















