Dlaczego dermatofitoza jest mylona z innymi chorobami skóry?
U psów
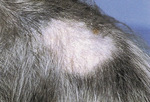
Dermatofitoza jest zaliczana do tzw. „czwórki wielkich naśladowców”. Jest tak dlatego, że obraz kliniczny jest tak różnorodny, że może sugerować wiele innych chorób skóry. Z obserwacji autorek wynika, że dermatofitoza u psów jest najczęściej mylona z zaawansowanym stadium powierzchownego bakteryjnego zapalenia skóry, kiedy to zazwyczaj nie obserwuje się już zmian w postaci ropnych krostek czy kryzek naskórkowych, a jedynie koliste wyłysienia o rozmiarze monety, rozsiane na owłosionej części skóry. Wyłysienia tego kształtu mogą występować także w przebiegu dematofitozy, choć warto wiedzieć, że w przypadku tej choroby mogą one również być owalne lub mieć kształt nieregularny, szczególnie w okolicach twarzowej, małżowin usznych oraz kończyn. Najbardziej jednak mylące w przebiegu dermatofitozy u psów jest to, że zmiany mogą mieć charakter zarówno zapalny, jak i niezapalny, mogą przebiegać z silnym rumieniem lub bez, silne złuszczanie naskórka może wystąpić, ale nie musi. Oznacza to, że nie istnieje jednolity obraz kliniczny dermatofitozy.
U kotów

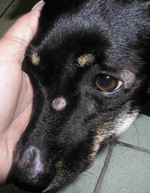
Również u kotów dermatofitoza może naśladować praktycznie wszystkie inne choroby dermatologiczne. Często występuje pod postacią prosówkowego zapalenia skóry, co powoduje, że nie jest w ogóle brana pod uwagę w diagnostyce różnicowej. Czasem dermatofitoza przybiera postać zapalenia mieszków włosowych, a nawet może objawiać się występowaniem trądziku podbródka, który klinicznie przypomina głębokie bakteryjne zapalenie mieszków włosowych, czyli ich czyraczność. W przypadku takich pacjentów rozstrzygające jest badanie materiału pobranego ze zmienionej skóry na podbródku. Problem w tym, że koci pacjent z trądzikiem podbródka najczęściej już podczas pierwszej wizyty otrzymuje lek przeciwzapalny oraz antybiotyk, a do domu zwykle bywa mu zalecane miejscowe stosowanie mupirocyny. O ile takie leczenie jest uzasadnione w przypadku głębokiego zapalenia mieszków włosowych na tle bakteryjnym (oczywiście wtedy lekiem przeciwzapalnym nie powinien być kortykosteroid), o tyle w przypadku dermatofitozy w formie trądziku podbródka terapia taka nie tylko nie zakończy się sukcesem, lecz nawet może zaszkodzić.
U kotów z grzybicą skórną może dochodzić do tak silnego złuszczenia naskórka, że może to prowadzić do podejrzenia pęcherzycy liściastej. W podejrzeniach tych lekarza może utwierdzić dodatkowo wystąpienie innych objawów, np. paronychii, czyli zapalenia wałów pazurowych. Także świąd nastręcza trudności w diagnozowaniu dermatofitozy. Chorobie tej może towarzyszyć świąd o różnym nasileniu, także bardzo silny, ale równie dobrze świąd w jej przebiegu może nie występować w ogóle.
Konkluzja jest niezbyt pocieszająca – u obu gatunków dermatofitoza może wyglądać jak prawie każda choroba skóry.
Jak diagnozować?
W związku z niezwykle różnorodnym obrazem klinicznym dermatofitozy, zarówno u psów, jak i u kotów, trzeba zdać sobie sprawę, że diagnoza ostateczna nie może być postawiona wyłącznie na podstawie objawów klinicznych, lecz musi być poparta badaniami.
Do prawidłowego wykonania takich badań niezbędne jest uwzględnienie tego, że dermatofity rosną w tkance martwej – łodygach włosowych, pazurach i warstwie rogowej naskórka. Badania dodatkowe stosowane w diagnozowaniu dermatofitozy można podzielić na trzy kategorie: badania doceniane i wykonywane w codziennej praktyce lekarskiej, badania przeceniane i często wykonywane w praktyce lekarskiej i wreszcie badania niedoceniane w codziennej praktyce lekarskiej, a zatem wykonywane rzadko.
Do pierwszej kategorii badań należy bez wątpienia zaliczyć hodowlę grzybów, słusznie uważaną za najbardziej wiarygodną metodę diagnostyczną. Do izolacji dermatofitów praktycy od lat wykorzystują komercyjne podłoże DTM (Dermatophyte Test Medium). Warto jednak wiedzieć, że hodowla na tym podłożu może dawać wyniki fałszywie dodatnie, a czas, po którym dochodzi do zmiany barwy z żółtej na malinową, jest uzależniony od liczby pobranych włosów, temperatury i wilgotności otoczenia. Dlatego też miarodajny wynik uzyskamy jedynie w laboratorium weterynaryjnym. Jeśli jednak zostanie podjęta decyzja o samodzielnym skorzystaniu z podłoża DTM, warto pamiętać, że wzrostowi białej lub białawej hodowli dermatofitów powinna towarzyszyć zmiana barwy podłoża na malinową, w przeciwnym razie może to oznaczać, że doszło do wzrostu grzybów saprofitycznych. Na podstawie liczby kolonii można stwierdzić, czy pacjent, z którego skóry pobrano próbkę, jest zakażony, czy też jest jedynie mechanicznym przenosicielem grzyba. W tym ostatnim przypadku obserwuje się znacznie mniejszą liczbę kolonii dermatofitów, gdyż mechaniczne przenoszenie jest wynikiem skażenia środowiska. W przypadku zakażonego zwierzęcia w hodowli obserwujemy bardzo dużą liczbę kolonii dermatofitów oraz intensywne wytwarzanie przetrwalników, czyli artrokonidiów.
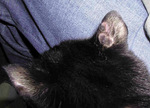
Do badań drugiego typu można zaliczyć badanie włosów w świetle lampy Wooda. W opinii autorek metoda ta ma ograniczoną wartość diagnostyczną i jest zdecydowanie przeceniana w praktyce weterynaryjnej. W badaniu tym wyniki fałszywie dodatnie i fałszywie ujemne występują w ponad 35% przypadków. Może to zatem prowadzić do postawienia błędnej diagnozy. Badanie to może być przydatne jedynie w przypadku Microsporum canis. To właśnie produkty przemiany materii tego gatunku fluoryzują w świetle lampy Wooda, a powinny być one widoczne wzdłuż łodyg włosowych, a nie na złuszczającym się zrogowaciałym naskórku. Oznacza to, że przykładanie świecącej lampy Wooda w miejsca rozległych wyłysień mija się z celem. Co ciekawe, tylko 50% dermatofitów z gatunku Microsporum canis daje pozytywne wyniki w badaniu lampą Wooda. Poza tym nie wolno zapominać, że lampa powinna być nagrzana przynajmniej 10 minut przed badaniem, wyniki uzyskane lampą nienagrzaną będą bowiem fałszywe. Tymczasem z obserwacji autorek wynika, że badania stosunkowo często są wykonywane po znacznie krótszym czasie nagrzewania lampy. Dla wiarygodności wyników otrzymanych przy wykorzystaniu lampy Wooda ważna jest również temperatura otoczenia. Fałszywy wynik badania lampą Wooda ze względu na zbyt niską temperaturę otoczenia otrzyma się w przypadku gdy badanie zostanie przeprowadzone zimą w gabinecie wcześniej dokładnie przewietrzonym, np. z powodu nieprzyjemnego zapachu powstałego podczas wizyty poprzedniego pacjenta. Poza tym należy mieć świadomość, że w badaniu w świetle lampy Wooda można uzyskać wyniki fałszywie dodatnie także w przypadku występowania innych drobnoustrojów, np. Pseudomonas aeruginosa, miejscowego stosowania na zmienionych chorobowo partiach skóry wielu preparatów weterynaryjnych, np. zawierających tetracyklinę, a także w sytuacji gdy na skórze badanego zwierzęcia występuje duża ilość wydzieliny gruczołów łojowych. Pamiętając o powyższych ograniczeniach, należy zaznaczyć, że lampa Wooda może być wykorzystana w pomieszczeniach takich jak kociarnie czy schroniska dla zwierząt do badania włosów na podłogach i legowiskach.
Badaniem niedocenianym, a przez to wykonywanym rzadko, jest mikroskopowe badanie włosa po wytrawieniu w chlorolaktofenolu lub wodorotlenku potasu. Wprawdzie włosy zakażone są znacznie grubsze od włosów niezakażonych ze względu na rozpulchnioną strukturę, a ich szorstka i nieregularna powierzchnia jest widoczna doskonale nawet w kropli oleju parafinowego bez wytrawiania, jednak badanie włosów niewytrawionych, a jedynie zanurzonych w oleju parafinowym, wymaga dużego doświadczenia. Charakterystycznym obrazem włosów zakażonych dermatofitem są przetrwalniki grzybów ułożone w formie łańcuszków wzdłuż pochewki włosa.
Jak pobierać materiał?
W przypadku występowania zmian skórnych w postaci uogólnionej, najprostszą prawidłową metodą pobierania materiału jest wyszczotkowanie zmienionych włosów wraz z łuszczącym się naskórkiem przy użyciu szczoteczki do zębów. Szczotkowanie powinno trwać do czasu zebrania stosunkowo dużej ilości materiału, na co zwykle wystarczają 2-3 minuty. W przypadku zmian ogniskowych, można wyrwać kępki włosów, ale trzeba pamiętać, że pobrana próbka musi zawierać sporą liczbę włosów, a nie – z czym czasami można się zetknąć – ich pojedyncze egzemplarze.
Jeśli pacjent – w szczególności dotyczy to kotów – jest podejrzewany o nosicielstwo dermatofita, wówczas najlepiej przetrzeć całą sierść wilgotnym ręcznikiem papierowym, a jego fragment następnie położyć na podłożu. Alternatywą jest pozostawienie pacjenta na kilka dni w klatce, a następnie zebranie do badania martwych włosów z podłogi. W przypadku podejrzewania nosicielstwa u kotów, którym z powodu ich zachowania trudno przetrzeć całą powierzchnię ciała, próbki najlepiej pobierać z okolic głowy, małżowin usznych oraz kończyn. Jeżeli w otoczeniu występują wysokie temperatury, warto próbki trzymać pokrywką do dołu, aby zapobiec skraplaniu się pary na powierzchni podłoża. Zakrętki próbek nie powinny być nigdy szczelnie dokręcone. Próbkę zawsze należy nakładać na podłoże delikatnie, unikając wciskania w nie pobranego materiału.

















