Śródmiąższowe zapalenie pęcherza moczowego kotów (FIC – feline interstitial cystitis) to jedno z wielu zaburzeń zaliczanych do zespołu chorób dolnych dróg moczowych (FLUTD – feline lower urinary tract disease). Określenie FIC wprowadzono do medycyny weterynaryjnej w latach 90. ubiegłego wieku, kiedy zauważono, że zmiany histopatologiczne u niektórych kotów z FLUTD są podobne do zmian występujących u ludzi chorych na śródmiąższowe zapalenie pęcherza (1).
Summary
Understanding FIC (Feline Interstitial/Idiopathic Cystitis)
Feline Interstitial/Idiopathic Cystitis (FIC) belongs to a group of disorders classified together as Feline Lower Urinary Tract Disease (FLUTD). Typically, the clinical presentation of FIC involves a young/middle aged cat presenting with different combinations of signs such as periuria, dysuria, stragnuria, pollakiuria and hematuria. It has been estimated that FIC accounts for more than 60% of cases of FLUTD among young cats. The article summarizes past and present theories regarding the etiopathogenesis of idiopathic cystitis as well as presents different treatment approaches.
Key words: idiopathic cystitis, etiopathogenesis, treatment, cats, feline idiopathic cystitis, interstitial cystitis, lower urinary tract
Najczęstszy obraz kliniczny FIC to kot w młodym lub średnim wieku z różnymi kombinacjami objawów, takich jak dysuria (utrudnione oddawanie moczu), stranguria (bolesne), pollakiuria (częste), periuria (oddawanie moczu w niewłaściwych miejscach) i hematuria (krwiomocz). Objawy te przybierają zwykle postać nagłego epizodu i u większości kotów samoistnie ustępują po 5-7 dniach, niezależnie od leczenia (2). Średnio u co drugiego kota mogą jednak nawracać w ciągu 1-2 lat (3), a u niektórych (< 15%) przybierać formę przewlekłą (2). Możliwe jest również wystąpienie obstrukcyjnej postaci FIC, zwłaszcza u samców (4, 5). Za czynniki predysponujące do rozwoju objawów uważa się niewychodzący tryb życia, brak aktywności i nadwagę (7, 10), spożywanie suchej karmy (8, 11), narażenie na stres (7, 10), życie w grupie (7, 10), a także płeć męską i kastrację (6, 7) [choć niektóre źródła podają brak predyspozycji płciowych (8, 9)]. Dane epidemiologiczne wskazują, że FIC dotyczy ponad 60% kotów przyprowadzanych do klinik weterynaryjnych z objawami FLUTD (6, 8).
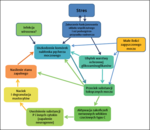
Śródmiąższowe zapalenie pęcherza moczowego jest nazywane zamiennie zapaleniem idiopatycznym, nieznana pozostaje bowiem jego etiologia, a patogeneza jest wciąż niezrozumiała. Skoro nie znamy przyczyny zaburzenia oraz mechanizmów jej działania, precyzyjna diagnostyka i skuteczne leczenie są praktycznie niemożliwe. Rozpoznawanie FIC polega wyłącznie na wykluczeniu wszelkich innych możliwych przyczyn zapalenia dolnych dróg moczowych, takich jak kamica moczowa, zakażenia bakteryjne, zaburzenia anatomiczne, zmiany nowotworowe i inne (tab. I). Leczenie zaś opiera się na działaniach empirycznych i często bywa nieskuteczne (lub z powodu błędów w diagnostyce i nieprzewidywalnej natury choroby skuteczność tę trudno ocenić).
W niniejszym opracowaniu przedstawione zostaną dawne i obecne koncepcje etiopatogenezy oraz wynikające z nich wskazówki dotyczące leczenia zapalenia pęcherza moczowego u kotów.
Medycyna człowieka a medycyna weterynaryjna
W badaniach naukowych nad etiologią lub patogenezą różnych chorób normą jest korzystanie z modeli zwierzęcych imitujących daną jednostkę chorobową. Zaburzenie może być w takich przypadkach wywoływane eksperymentalnie lub też może występować naturalnie. Do badania śródmiąższowego zapalenia pęcherza (IC – interstitial cystitis) wykorzystywano dotychczas 16 zwierzęcych modeli eksperymentalnych (12). Samoistnie IC występuje natomiast tylko u dwóch gatunków – kotów i ludzi. Z tego powodu lekarze weterynarii oraz urolodzy medycyny człowieka bardzo często wymieniają się spostrzeżeniami i korzystają z wzajemnych wyników badań w tym obszarze.
Problem występowania objawów związanych z dolnymi drogami moczowymi bez znanej przyczyny jest obserwowany u ludzi od około 200 lat i nadal pozostaje dużym wyzwaniem medycyny. Problem ten występuje około 4-5-krotnie częściej u kobiet niż u mężczyzn (13). Jest to choroba bardzo frustrująca zarówno dla pacjentów, jak i dla lekarzy. Chorzy skarżą się na przewlekły, nasilający się, często znikający i nawracający ból w okolicy miednicy oraz uczucie dyskomfortu i ucisku przy wypełnionym pęcherzu, które ustępuje po jego opróżnieniu. Z czasem dołączają się objawy częstego oddawania moczu, nokturii, hematurii.
Do niedawna IC diagnozowano na podstawie współistnienia trzech kryteriów: 1) obecności wymienionych objawów, 2) braku dowodów na istnienie innych przyczyn, 3) stwierdzenia zmian morfologicznych w badaniu cystoskopowym (obrzęk, przekrwienie, wylewy podśluzówkowe lub tzw. owrzodzenia Hunnera, czyli obszary z całkowitym brakiem nabłonka, gdzie naciek zapalny obejmuje wszystkie warstwy ściany pęcherza) i histopatologicznym wycinków tkanek (nacieki komórek zapalnych, mastocytów, zwłóknienia) (14). Coraz częściej jednak okazuje się, że, zwłaszcza w fazie początkowej choroby, zmiany w błonie śluzowej pęcherza moczowego nie są w ogóle stwierdzane, a te, które da się zaobserwować, spotykane są też w przebiegu innych chorób (14). Z tego powodu obecnie nazwę IC zastępuje się szerszą – zespół bolesnego pęcherza (BPS – Bladder Pain Syndrome), a za chore i podlegające konieczności leczenia uznaje się wszystkie osoby spełniające tylko dwa pierwsze kryteria doboru – występowanie objawów klinicznych i wykluczenie innych przyczyn (15).
IC/BPS wydaje się zatem chorobą bardzo podobną do kociego FIC. Pierwsze doniesienie sugerujące analogie między chorymi ludźmi i kotami pochodzi z lat 90. (1). Dziś powszechnie uznaje się koci FIC za jedyny naturalnie występujący model ludzkiego IC (16, 17). Również u kotów obecnie sugeruje się, że istnienie wyżej wymienionych zmian morfologicznych w ścianie pęcherza nie jest patognomoniczne dla FIC (3, 5, 18), a jedyną metodą rozpoznawania pozostaje diagnoza przez wykluczenie innych chorób. Wyraźna różnica między chorymi ludźmi i kotami dotyczy predylekcji płciowej – u ludzi częściej chorują kobiety, natomiast u kotów nie wykazano większej zachorowalności u samic, a niektóre źródła podają wzrost predyspozycji u samców (6). Wspólną cechą śródmiąższowego zapalenia pęcherza u obu gatunków jest na pewno nierozwiązany problem jednoznacznego i szybkiego rozpoznawania oraz brak sprawdzonych schematów leczenia. Dlatego na całym świecie wciąż poszukuje się czułej i pewnej metody diagnostycznej, poprzez liczne badania kliniczne, laboratoryjne i molekularne (19, 20). Wydaje się jednak, że bez zrozumienia, czym właściwie jest IC, postęp w walce z tą chorobą jest niemożliwy.
Tradycyjnie diagnozowane przyczyny FLUTD i obecne poglądy na temat możliwości ich udziału w rozwoju FIC
Zakażenie bakteryjne
W latach 60.-70. za przyczynę zaburzeń dotyczących dolnych dróg moczowych u kotów uważano przede wszystkim zakażenia bakteryjne (UTI – Urinary Tract Infection) (2). Rozpoznanie ustalano na podstawie objawów klinicznych typowych dla FLUTD, wyników badań laboratoryjnych oraz pozytywnej reakcji na leczenie antybiotykami. Nie wykonywano wówczas rutynowo posiewów moczu, bakteriurię stwierdzano w wynikach badań mikroskopowych niebarwionego osadu, a moczu nie pobierano w sposób zapewniający jałowość (2). Postępowanie takie prowadziło do błędnych interpretacji i niewłaściwych rozpoznań.
Obecnie w celu rozpoznania zakażeń układu moczowego powszechnie zaleca się wykonywanie posiewów i antybiogramu, a mocz w tym celu pobiera się drogą nakłucia pęcherza (cystocentezy). Stosowanie wiarygodnej diagnostyki wykazało, że mniej niż 2% przypadków FLUTD u kotów do 10. roku życia jest pierwotnie spowodowane zakażeniami bakteryjnymi (8, 21). Ryzyko zakażeń wzrasta jedynie u kotów cewnikowanych, po uretrostomiach oraz starszych, u których spada zdolność zagęszczania moczu, a tym samym jego właściwości antybakteryjne (22). Również w badaniach nad udziałem mikroorganizmów z rodzaju Mycoplasma i Ureaplasma w patogenezie FLUTD nie uzyskano pozytywnych wyników zarówno w hodowli (21, 23), jak i w badaniach PCR próbek moczu (24). Ponadto wykazano, że dysuria u większości kotów z zapaleniem pęcherza ustępuje samoistnie, efekt antybiotykoterapii przestał być zatem potwierdzeniem zakażenia. W efekcie koncepcja bakteryjnego podłoża większości przypadków FLUTD jest obecnie nieaktualna. Oczywiście można założyć, że zalegające na dnie pęcherza erytrocyty, nierzadko zasadowe pH moczu i potencjalne uszkodzenie bariery ochronnej błony śluzowej dróg moczowych w wyniku stanu zapalnego u kotów z FIC mogą być czynnikami predysponującymi do zakażeń wtórnych (25), jednak antybiotykoterapia w przypadkach FIC nie jest zalecana w żadnym z dostępnych źródeł.
Kamica fosforanowo-amonowo-magnezowa (struwitowa)
W latach 80.-90. skupiono uwagę na często wówczas stwierdzanej krystalurii i kamicy moczowej, głównie struwitowej. Jej występowanie wiązano z dużą zawartością magnezu i zmienianiem pH moczu przez komercyjne suche karmy dla kotów, które w tamtych czasach stały się bardzo popularne (2). Wprowadzenie karm zakwaszających z ograniczoną zawartością Mg rzeczywiście zmniejszyło występowanie struwitów w kocim moczu. Masowe stosowanie tych karm np. w Stanach Zjednoczonych spowodowało co prawda wzrost udziału szczawianów wapnia w tworzeniu kamieni moczowych, ale przy dalszym postępie technologii żywieniowych częstość występowania kamicy obu typów spada. Ocenia się, że obecnie objawy FLUTD są powodowane przez kamicę moczową tylko w 10-20% przypadków zachorowań (6, 8). Rozważano również udział kamicy w powstawaniu śródmiąższowego zapalenia pęcherza, ponieważ u 25% kotów z FIC obserwuje się w moczu obecność niewielkiej liczby kryształków (8). Stwierdzono jednak, że nie świadczą one o pierwotnej krystalurii (9, 18). Koty z FIC (najczęściej karmione suchą karmą i mało aktywne) produkują niewielkie ilości zagęszczonego i rzadko oddawanego moczu, a proteinuria związana ze stanem zapalnym (9) i wywołane stresem przyspieszenie oddechu (hiperwentylacja) (16) skutkują zmianą pH moczu na zasadowy. Wówczas zwiększa się ryzyko krystalizacji i ilość powstających struwitów. Wielu autorów podkreśla jednak, że kryształki nie są w stanie uszkadzać zdrowego nabłonka dróg moczowych (urothelium) (9, 18), a więc nie powinny być pierwotną przyczyną dysurii, strangurii czy hematurii. Wytrącanie się kryształów bywa też często efektem zbyt długiego przetrzymywania moczu przed analizą. Ponadto w pęcherzu każdego zdrowego kota mogą powstać niewielkie ich ilości (22). Nieznaczna krystaluria jest zatem zjawiskiem wtórnym i(lub) artefaktem i uważa się, że nie ma klinicznego znaczenia u kotów z FIC. Stosowanie u nich diet zakwaszających mocz nie przynosi rezultatów i wydaje się pozbawione sensu (3, 5, 22). Wyjątkiem są rzadkie przypadki FIC przebiegające z niedrożnością dróg moczowych, kryształki mogą bowiem uczestniczyć w tworzeniu czopów białkowo-erytrocytarnych i nasilać ich powstawanie. Wówczas można rozważyć przyspieszenie ich rozpuszczania poprzez stosowanie odpowiednich karm (5, 22).















