Glikokortykosteroidy (GKS)
Preparaty glikokortykosteroidów zostały wprowadzone do leczenia chorób skóry w 1952 r. przez Sulzbergera i Wittena (31). Należą do najczęściej stosowanych leków przeciwalergicznych, przeciwzapalnych, antyproliferacyjnych i immunosupresyjnych, ponieważ hamują procesy zapalne na wszystkich etapach odpowiedzi immunologicznej – od indukcji po fazę efektorową. Każdy z preparatów GKS, niezależnie od drogi podania, przenika w sposób bierny do komórki lub po związaniu się z receptorem glikokortykosteroidowym (GR) oddziałuje na DNA komórki, stymulując lub hamując transkrypcję genów, w wyniku czego dochodzi do pobudzenia lub hamowania syntezy swoistych białek. Znane są dwa mechanizmy działania GKS – genowo swoisty, związany z bezpośrednim pobudzeniem receptora cytozolowego-DNA komórki, i pozagenowy (receptorowy), związany z obecnością receptorów błon komórkowych (5, 13).
Pozagenowy (receptorowy) mechanizm działania immunomodulującego opiera się na zdolności wiązania cząsteczki glikokortykosteroidu z cytoplazmatycznym receptorem GR błony komórkowej. Powstanie kompleksu GR–GKS powoduje uwolnienie z GR białek chaperonowych szoku termicznego Hsp 90, dzięki czemu aktywny kompleks GR–GKS może przechodzić przez błonę jądrową do jądra komórkowego i łączyć się z genami regulatorowymi DNA, zwanymi elementem odpowiedzi na GKS, czyli GRE – glucocoticoid response elements. Powoduje to, że glikokortykosteroidy mogą bezpośrednio stymulować syntezę białek przeciwzapalnych, takich jak lipokortyna-1 lub wazokortyna, jak też pośrednio hamować syntezę receptorów dla cytokin i samych cytokin (IL-1, IL-3, IL-4, IL-5, IL-6, Il-8, IL-11, IL-13). Lipokortyna-1, będąca inhibitorem fosfolipazy A i mediatorów zapalenia (prostaglandyn), hamuje proliferację limfocytów oraz migrację monocytów do miejsca zapalenia. Natomiast wazokortyna bierze udział w mechanizmie zwężania naczyń, przez co zmniejsza tworzenie wysięku zapalnego.
W przypadku chorób immunologicznych droga receptorowa pozagenowa jest najważniejszą drogą działania GKS, ponieważ u pacjentów z czynnym procesem zapalnym liczba dostępnych receptorów błon komórkowych jest dużo większa niż u osobników zdrowych. Z tych to powodów GKS mają większy zasięg działania i aktywność biologiczną u osobników chorych, a reakcja na nie jest inna niż u osobników zdrowych (5, 13). W efekcie pod wpływem glikokortykosteroidów (16, 26, 18, 34) dochodzi do stabilizacji błon lizosomalnych, zahamowania syntezy prostaglandyn, spadku stężenia histaminy i bradykininy oraz produkcji cytokin, takich jak IL-1, IL-2, IL-6, IFN-gamma i TNF-alfa, co skutkuje zahamowaniem proliferacji limfocytów T. GKS, poprzez pobudzanie syntezy lipokortyn, hamują aktywność komórek biorących udział w fazie efektorowej odpowiedzi immunologicznej, takich jak neutrofile, makrofagi i monocyty, a tym samym hamują one zjawiska chemotaksji, fagocytozy i zdolności bakteriobójczych komórek. Podawanie psom prednizolonu w dawce doustnej 1 mg/kg m.c./dzień o godzinie 8.00 przez kolejne 5 dni powoduje już w ciągu pierwszej doby zmiany w parametrach hematologicznych krwi (25). W czasie pierwszych 24 godzin stwierdza się wzrost liczby krwinek białych we krwi, ponieważ rośnie udział procentowy neutrofilów i monocytów, co jest wynikiem zmniejszonej zdolności tych komórek do chemotaksji i diapedezy. Natomiast po 24 godzinach obserwowany jest postępujący spadek liczby krwinek białych, procentowego udziału neutrofilów, limfocytów i eozynofilów, co wynika ze zmniejszonej aktywności szpiku kostnego (25).
W naukach klinicznych ogólnie przyjęty jest pogląd (11, 13, 32), że dawki GKS powinny być tak duże, aby były skuteczne, i tak małe, aby nie powodowały ubocznych/niepożądanych objawów klinicznych. Stosując preparaty glikokortykosteroidowe, należy pamiętać o zjawisku tachyfilaksji, które polega na braku reakcji skóry na stosowany lek po okresie wysycenia receptorów GR błon komórkowych. Dlatego też zalecane są kilkudniowe przerwy w ich stosowaniu po okresie wysycenia (13). Należy obserwować stan kliniczny chorego i w miarę możliwości obniżać dawki leku, podawać go w sposób alternatywny (co drugi dzień) lub pulsacyjny (codziennie przez kilka dni z kilkudniowymi przerwami). Ważne jest, aby GKS podawać we wczesnych godzinach rannych i jednorazowo, ponieważ stężenie endogennego kortyzolu zmienia się zgodnie z rytmem dobowym i jest najniższe w nocy, a najwyższe rano. Taki sposób podawania leku zapewnia ochronę kory nadnerczy przed zanikiem i warunkuje sprzężenie zwrotne osi podwzgórzowo-przysadkowej.
W chorobach alergicznych skóry psów najczęściej stosowane są prednizon, prednizolon i metyloprednizolon, które są podawane doustnie. Zastosowanie dawki prednizonu 0,5 mg/kg/ /dzień przez 7 dni (17) u psów z atopowym zapaleniem skóry spowodowało redukcję świądu u 56%, a zmian skórnych u 61% psów.
Biodostępność prednizonu oceniana jest wprawdzie na 80% w stosunku do prednizolonu (34), ale nie stwierdza się klinicznych i farmakokinetycznych różnic między lekami. Prednizolon podawany doustnie psom z AZS w dawce 0,5 mg/kg/dzień (16) redukował zmiany skórne i świąd w 69% przypadków. Ocena skuteczności klinicznej metyloprednizolonu w dawce doustnej 0,4-0,8 mg/kg/dzień przez 7 dni u psów z atopowym zapaleniem skóry (6) wypadła zadowalająco u 75% pacjentów.
W praktyce klinicznej u psów z atopowym zapaleniem skóry najczęściej zaleca się (18, 21, 22, 23, 26) stosowanie doustne glikokortykosteroidów umiarkowanie długo działających, które powinny być podawane przez 3-7 dni codziennie, a przy dłuższym stosowaniu przerwy pomiędzy kolejnymi podaniami mogą wynosić 2, 3 lub 4 dni.
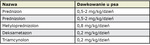
Najsilniejsze efekty przeciwświądowe uzyskuje się po doustnym stosowaniu prednizonu, prednizolonu i metyloprednizolonu (tab. I) w dawce 0,5-1,0 (maks. 2,0) mg/kg/dzień, przy czym terapię należy rozpocząć od dawek najniższych (18).
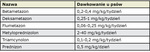
Z glikokortykosteroidów o przedłużonym działaniu stosowane mogą być doustnie deksametazon i triamcynolon w dawce 0,2 mg/kg/ /dzień. W leczeniu atopowego zapalenia skóry psów stosowane są także glikokortykosteroidy w formie iniekcyjnej (tab. II). Przeznaczone są do tego glikokortykosteroidy o przedłużonym okresie działania (triamcynolon, flumetazon, betametazon, deksametazon), które są podawane w dużo mniejszych dawkach i dużo rzadziej (co 3-7 dni) niż glikokortykosteroidy umiarkowanie długo działające, ponieważ ich dłuższe działanie może doprowadzić do zaniku kory nadnerczy.
Cyklosporyna, cyklosporyna A (CsA)
Cyklosporyna jest często stosowanym lekiem immunosupresyjnym w transplantologii, nefrologii, reumatologii, gastroenterologii, dermatologii i okulistyce. Należy do grupy leków nazywanych inhibitorami kalcyneuryny (1, 7, 20, 29, 30, 33, 34, 36). Kalcyneuryna wchodzi w skład szlaku sygnalizacyjnego prowadzącego do aktywacji limfocytów T, a rozpoznanie antygenu przez limfocyt T jest podstawą rozwoju i regulacji odpowiedzi immunologicznej w przypadku podania pacjentowi cyklosporyny. Blokowanie aktywności kalcyneuryny jest jedną z metod postępowania przeciwzapalnego w lecznictwie dermatologicznym, między innymi w atopowym zapaleniu skóry ludzi i psów (1, 12, 15, 17, 27, 29, 30, 35). Brak możliwości prezentacji alergenu limfocytom T oraz wytwarzania mediatorów reakcji zapalnych hamuje powstawanie zmian skórnych i rozwój dermatoz wikłających.
Cyklosporyna A hamuje szereg funkcji limfocytów T, przede wszystkim ich aktywację, zdolność prezentacji antygenów i wydzielanie prozapalnych cytokin (7, 9, 14, 17, 19, 30, 34). Jej hamujący wpływ na limfocyty T (głównie pomocnicze – Th) poprzez uniemożliwianie rozpoznania antygenu ostatecznie obniża produkcję prozapalnych cytokin, tym samym powoduje spadek aktywności immunologicznej keratynocytów, komórek Langerhansa w naskórku oraz zmniejsza aktywność komórek efektorowych (eozynofilów, mastocytów) biorących udział w odpowiedzi immunologicznej. Poza tym, w przeciwieństwie do GKS, cyklosporyna nie wpływa na hematopoezę, fagocytozę i jest metabolizowana przy udziale cytochromu P450 w wątrobie (34).
Do grupy inhibitorów kalcyneuryny stosowanych w chorobach skóry należą oprócz cyklosporyny także takrolimus i pimekrolimus. Według niektórych autorów w leczeniu atopowego zapalenia skóry (1, 8) charakteryzującego się zaburzeniami regulacji immunologicznej długoterminowe stosowanie glikokortykosteroidów prowadzi do rozwoju steroidoopornej postaci AZS, wywołanej przede wszystkim kolonizacją Staphylococcus spp., dlatego też inhibitory kalcyneuryny stanowią doskonałą dla nich alternatywę. Inhibitory kalcyneuryny, w przeciwieństwie do glikokortykosteroidów, hamują kolonizację skóry przez Staphylococcus spp., a przez to zapobiegają powstawaniu superantygenów, dlatego niektórzy autorzy sugerują, aby inhibitory kalcyneuryny były zalecane jako leki pierwszego rzutu w leczeniu AZS, a glikokortykosteroidy jako leki „ratunkowe”.
Ryc. – I. Taszkun
PIŚMIENNICTWO
1. Boguniewicz M.: Postępy w rozumieniu zespołu atopowego zapalenia skóry: drobnoustroje i makrolaktony. Alergia Astma Immunologia, 2004, 9, 169-173. – 2. Borel J.F., Feurer C., Gubler H.U.: Biological effects of cyclosporin A: a new antilymphocytic agent. Agents Action, 1976, 6, 468-475. – 3. Burton G., Burrows A., Walker R., Robson D., Basset R., Bryden S., Hill S.: Efficacy of cyclosporine in the treatment of atopic dermatitis in dogs – combined results from two veterinary dermatology referral centers. Austr. Vet. J., 2004, 82, 11, 681-685. – 4. Griffin C., Kwoczka K., MacDonald J.: Current Veterinary Dermatology, Mosby Year Book, 1993. – 5. Grzanka A., Rogala B., Grzanka A., Rogal B.: Molecular mechanism of glucocorticoids and difficult asthma. Alergia Astma Immunologia, 2000, 5, 247-252. – 6. Guaguere E., Lasvergeres F., Arfi L.: Efficacy of oral methylprednisolone in the symptomatic treatment of allergic dermatitis. Prat. Med. Chir. Anim. Cie. 1996, 31, 171-175. – 7. Gupta A.K., Brown M.D., Ellis C.N. i wsp.: Cyclosporine in dermatology, J. Am. Acad. Dermatol, 1989, 21, 1245-1256. – 8. Hauk P.J., Hamid Q.A., Chrousos G.P.: Induction of corticosteroid intensivity in human peripheral blood mononuclear cells by microbial superantigens. J. Allergy Clin. Immunol., 2000, 105, 782-787. – 9. Hess A.D.: Mechanisms of action of cyclosporine: considerations for the treatment of autoimmune diseases. Clin. Immunolo. Immunopathol., 1993, 68, 220-228. – 10. Hillier A., Griffin C.E.: The ACVD task force on canine atopic dermatitis: in there a relationship between canine atopic dermatitis and cutaneus adverse food reactions? Vet. Immunol. Immunopathol., 2001, 81, 227-231.
11. Kowalski M.L.: Immunologia kliniczna, Mediton Oficyna Wydawnicza, 2000. – 12. Logan R.A., Camp R.D.: Severe atopic egzema: response to oral cyclosporin A. J Res. Soc. Med., 1988, 81, 417-418. – 13. Mackiewicz S.: Glikokortykosteroidy – mity i fakty. Glucocorticoid therapy – success or illusion. Reumatologia, 2007, 45, 4, 198-204. – 14. Naeyaert J.M., Lachapelle J.M., Degreef H., de la Brassinne M., Heenen M., Lambert J.: Cyclosporin in atopic dermatitis – reveiw of the literature and outline of a Belgian consensus. Dermatology, 1999, 198, 145-152. – 15. Nghiem P., Pearson G., Langley R.G.: Tacrolimus and pimecrolimus: from clever prokaryote to inhibiting calcineurin and treating atopic dermatitis. J. Am. Acad. Dermatol., 2002, 46, 228-241. – 16. Olivry T., Sousa C.A.: The ACVD task force on canine atopic dermatitis (XX): glukokorticoid pharmacotherapy. Vet. Immunol. Immunopathol., 2001, 81, 317-322. – 17. Olivry T., Rivierre C., Jackson H.A., Murphy K.M., Davidson G., Sousa A.: Cyclosporine decreases skin lesions and pruritus in dogs with atopic dermatitis: a blinded randomized prednisolone-controlled trial. Vet. Dermatol., 2002, 13, 77-87. – 18. Olivry T., DeBoer D.J., Favrot C., Jackson H.A., Mueller R.S., Nuttal T., Prelaud P.: Treatment of canine atopic dermatitis: 2010 clinical practice guidelines from the International Task Force on Canine Atopic Dermatitis. Vet. Dermatol. 2010, 21, 233-248. – 19. Oran A., Marshall J.S., Kondo S., Paglia D., McKenzie R.C.: Cyclosporin inhibit intercellular adhesion molecule-1 expression and reduces mast cells in the asebia mouse model of chronic skin inflammation. Br. J. Dermatol., 1997, 136, 519-526. – 20. Pierzchała E., Brzezińska-Wcisło L., Lis-Święty A.: cyklosporyna A – znaczenie i zastosowanie w dermatologii. Dermatol. Kliniczna, 2004, 6, 183-190.
21. Pomorski J.H.: Wybrane zagadnienia dermatologiczne psów i kotów. Zakład Diagnostyki Klinicznej Wydziału Medycyny Weterynaryjnej, Lublin 1999. – 22. Prelaud P.: Alergiczne zapalenia skóry u psów i kotów. Sanmedia – Wydawnictwo Medyczne, Warszawa, 1995. – 23. Reedy L.M., Miller W.H., Willemse T. (ed.): Allergic skin diseases of dog and cat. 2ed edition. WB. Saunders, London, UK, 1997. – 24. Ryffel B., Donatsch P., Madorin M., Matter B.E., Ruttimann G., Schon H., Stoll R., Wilson J.: Toxicology evaluation of cyclosporine A. Arch. Toxicol. 1983, 53, 107-141. – 25. Schalm O.W., Jain N.C., Carrol E.J.: Veterinary hematology 3rd edition, Lea&Febiger, Philadelphia, 1995, pp. 82-218. – 26. Scott D., Miller W., Griffin C.: Muller & Kirk’s Small Animal Dermatology, 6th Edition, W.B. Saunders Comp., Philadelphia USA, 2001. – 27. Silny W., Gliński W., Czarnecka-Operacz M. i wsp.: Ocena skuteczności cyklosporyny A (Sandimun-Neoral) w leczeniu ciężkich przypadków atopowego zapalenia skóry. Przegląd Dermatol., 1997, 84, 205-214. – 28. Sousa C.A., Halliwell R.E.W.: The ACVD task force on canine atopic dermatitis (XI): the relationship between arthropod hypersensitivity and atopic dermatitis in dog. Vet. Immunol. Immunopathol. 2001, 81, 233-237. – 29. Steffan J., Alexander D., Brovedani F., Fisch R.: Comparison of cyclosporine A with methylprednisolone for treatment of canine atopic dermatitis a parallel, binded, randomized controlled trial. Vet. Dermatol. 2003, 14, 11-22. – 30. Steffan J., Favrot C., Mueller R.: A systematic review and meta-analysis of the efficacy and safety of cyclosporine for the treatment of atopic dermatitis in dogs. Vet. Dermatol., 2006, 17, 3-16.
31. Sulzberger M.B., Witten V.H.: The effect of topically applied compound F in selected dermatoses. J. Invest. Dermatol., 1952, 19, 101-102. – 32. Szczeklik A. (red): Internal diseases. A multimedia handbook based on EBM rules. Volume 2. Chapter VIII. Allergic diseases.1st ed. Medycyna Praktyczna, Kraków, 2006. – 33. Świerkot J., Gruszecka-Marczyńska K., Szechiński J.: Sześciomiesięczne badanie kliniczne oceniające skuteczność i bezpieczeństwo stosowania cyklosporyny u chorych na reumatoidalne zapalenie stawów. Reumatologia, 2005, 43/5, 257-264. – 34. Taylor A.L., Watson C.J.E., Bradley J.A.: Immunosuppresive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy. Critical Revievs in Oncology/Hematology, 2005, 56, 23-46. – 35. Van Joost T., Stolz E., Heule F.: Efficacy of low-dose cyclosporine in severe atopic disease. Arch. Dermatol, 1987, 123, 166-167. – 36. Wąsik F., Kołodziej T.: Wskazania do stosowania cyklosporyny A w chorobach skóry o podłożu immunologicznym. Medipress Dermatol., 1999, 4, 15-17.