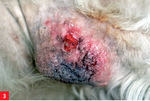
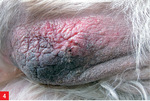
Leiszmanioza jest chorobą wywoływaną przez pierwotniaki (wiciowce) z rodzaju Leishmania. Pełny cykl rozwojowy tych wiciowców wymaga obecności dwóch żywicieli – moskita z rodzaju Phlebotomus oraz kręgowca (np. człowieka, psa, gryzonia). W Hiszpanii i południowych Włoszech antygen Leishmania infantum wykryto także u 40-75% badanych lisów (1).
Summary
Leishmaniasis in a dog – a case report
A five-year-old male golden retriever presented with cutaneous problems and gradually deteriorating overall health. Further clinical symptoms and laboratory findings led to the suspicion of leishmaniasis, which was subsequently confirmed by biopsy and serological testing. The initial therapy with allopurinol and meglumine antimonate had to be revised because of significant adverse reactions. The second-line therapy was a combination of miltefosine and allopurinol. The patient was monitored for more than two years of diagnostic work-up and therapy.
Key words: canine leishmaniasis, allopurinol, meglumine antimonate, miltefosine

Ze względu na drogę przenoszenia leiszmanioza jest chorobą o charakterze endemicznym, co jest związane z ograniczonym terytorium występowania moskitów z rodzaju Phlebotomus (Europa, Afryka i Azja) i innych. W Europie do takich rejonów należą kraje Basenu Morza Śródziemnego, a także Portugalia. Na tych obszarach inwazja u psów bardzo często ma przebieg bezobjawowy i dopiero badania przesiewowe wykazują wysoki odsetek osobników seropozytywnych, który sięga 20-26% (2, 3). Według niektórych opracowań (1) odsetek ten może wynosić nawet 50%, mimo że klinicznie choroba występuje tylko u 3-5% osobników. Tym samym psy, jako zwierzęta najczęściej towarzyszące człowiekowi, stanowią główny rezerwuar pasożyta, który może być przenoszony na ludzi lub inne zwierzęta za pośrednictwem owadów. Jest to tym bardziej istotne, że nawet terapia nie daje gwarancji pełnego wyleczenia i zazwyczaj prowadzi jedynie do zahamowania namnażania pasożyta w organizmie zwierzęcia. Nawet po ustąpieniu objawów klinicznych zwierzę wciąż stanowi rezerwuar leiszmanii i wymaga stałego nadzoru pod kątem nawrotu choroby. U ludzi choroba rozwija się w postaci skórnej lub trzewnej i stanowi trzecią (po malarii i filariozie limfatycznej) pod względem częstości występowania chorobę przenoszoną przez owady. Szacuje się, że na terenie 88 państw znajdujących się na obszarach endemicznego występowania leiszmaniozy żyje 350 milionów ludzi narażonych na ryzyko zachorowania (4).
W Polsce leiszmanioza wciąż wydaje się zjawiskiem marginalnym, należy się jednak spodziewać, że wraz z częstszymi zagranicznymi podróżami, w których towarzyszą właścicielom ich zwierzęta, wzrośnie także zagrożenie występowania szeregu chorób związanych z klimatem tropikalnym lub subtropikalnym. Postawienie trafnej diagnozy jest trudne nie tylko ze względu na rzadkie występowanie tej choroby w naszym kraju, ale także z uwagi na szeroki zakres możliwych objawów oraz bardzo długi, często wieloletni okres inkubacji, co powoduje, że informacja o odbytych w przeszłości podróżach może zostać przeoczona w wywiadzie. Należy przy tym zaznaczyć, że o ile w krajach występowania wektora choroby zarażony pies może stanowić zagrożenie dla ludzi, o tyle w naszej strefie klimatycznej ryzyko związane z ewentualnym przeniesieniem pasożyta na człowieka jest bliskie zeru. Nie udowodniono bowiem dotychczas możliwości bezpośredniej transmisji pasożyta z psa na psa lub z psa na człowieka z pominięciem wektora (5). Nieliczne przypadki zachorowań u zwierząt nigdy nieprzebywających na terenach endemicznych mogą być tłumaczone transfuzją krwi od bezobjawowego nosiciela (6), transmisją pionową [przez łożysko – z zarażonej suki na szczenię (7)] lub przenoszeniem wiciowców drogą płciową (z zarażonego psa na sukę) (1). Brak również jednoznacznych dowodów na ryzyko bezpośredniej transmisji z psa na psa, mimo że notowane są także przypadki choroby u zwierząt nigdy nienarażonych na pozostałe drogi zakażenia w krajach, gdzie nie występuje żaden z typowych wektorów choroby [np. w USA (1)]. Przypuszczenia o możliwości przeniesienia wiciowca przez ektopasożyty strefy umiarkowanej nie zostały potwierdzone, mimo to coraz częściej mówi się również o możliwości przenoszenia Leishmania spp. przez pchły lub kleszcze, głównie z rodzaju Rhipicephalus sanguineus (8) (pojawiły się także doniesienia stwierdzające obecność trofozoitów leiszmanii w rozmazach z kleszczy Rhipicephalus sanguineus – McKenzie K. 1984, PhD Dissertation Oklahoma State University).
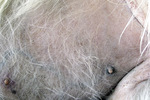

Do gatunków pasożyta wywołujących zachorowania u psów zalicza się Leishmania tropica, L. infantum, L. chagasi, L. mexicana i L. brasiliensis. Wszystkie te gatunki mogą również pasożytować u ludzi, a dwa z nich (L. infantum i L. tropica) występują w Europie (Basen Morza Śródziemnego i Portugalia). W organizmie kręgowca pasożyty te tracą wić i przyjmują formę amastigota, namnażając się wewnątrz makrofagów oraz komórek dendrytycznych gospodarza. U części zwierząt nie dochodzi do rozwoju choroby dzięki odpowiedzi typu komórkowego, kiedy to limfocyty Th1 wydzielają IL-2, IL-12 oraz IFN-gamma – cytokiny konieczne do aktywacji makrofagów, odpowiedzi limfocytów cytotoksycznych oraz komórek NK. Pobudzenie mechanizmów odporności komórkowej prowadzi do niszczenia pasożytów. Większość objawów klinicznych choroby jest więc związana z reakcją układu odpornościowego, kiedy to równowaga odpowiedzi komórkowej (Th1) i humoralnej (Th2) przesuwa się na korzyść tej drugiej. Skutkuje to wytwarzaniem dużych ilości przeciwciał, które jednak nie spełniają funkcji ochronnej, a tworzone z ich udziałem kompleksy immunologiczne stanowią jeden z głównych czynników patogenetycznych w przebiegu leiszmaniozy. Zwalczenie infekcji jest uzależnione od odpowiedzi komórkowej (zależnej od Th1), co tłumaczy względny brak podatności na chorobę tych osobników, u których równowaga immunologiczna jest przesunięta właśnie w stronę tego typu reakcji odpornościowej (9). Podatność na zachorowanie jest także związana z rasą, a do najbardziej narażonych na rozwój klinicznej leiszmaniozy zalicza się rottweilery, boksery, cocker spaniele i owczarki niemieckie (1).
Opis przypadku
Pacjent: golden retriever Karat, samiec, ur. 3.08.2003.
Uraz? Alergia? Niedobory żywieniowe?
Pies trafił do lecznicy zimą 2008 roku z powodu niegojącej się zmiany na opuszce V palca lewej kończyny piersiowej. Leczenie maściami i opatrunkiem nie dało rezultatu. Już w tym czasie lekarz prowadzący zauważył pogorszenie się stanu okrywy włosowej psa i zalecił dodatek do karmy preparatu zawierającego nienasycone kwasy tłuszczowe. Ponadto już wcześniej pies miał na łokciach zmiany o charakterze modzeli, nie były one jednak na tyle rozległe, by stanowić niepokojący dla właściciela sygnał u psa w tym wieku oraz tej wielkości.
Dalszą diagnostykę, od maja 2009 roku, prowadzono w Katedrze Chorób Wewnętrznych z Kliniką Koni, Psów i Kotów Uniwersytetu Przyrodniczego we Wrocławiu. Biopsja zmiany na opuszce wykazała stan zapalny bez cech nowotworzenia. Zalecono stosowanie maści Mecortolon N, po której opuszka zagoiła się i uległa zmniejszeniu. Po zaprzestaniu stosowania leku dochodziło jednak do nawrotów. Próby stosowania innych leków (maść z witaminą A, maść cynkowa, maść tranowa) nie dawały rezultatów. Jednocześnie powoli ulegał pogorszeniu stan skóry na łokciach i okrywy włosowej. Sierść nie wypadała nadmiernie, ale też nie odrastała, stawała się coraz rzadsza i matowa.
Latem 2009 pies zaczął chudnąć, mimo jedzenia coraz większych ilości karmy. Badanie biochemiczne krwi, wykonane we wrześniu 2009 roku, nie wykazało niepokojących zmian (enzymy wątrobowe, mocznik, amylaza, amoniak, cholesterol, sól, potas i chlorki w normie; kreatynina poniżej normy). W badaniu morfologicznym stwierdzono limfopenię oraz liczbę erytrocytów w dolnej granicy normy [5,58 T/l (norma 5,50-8,90 T/l)]. W diagnostyce różnicowej brano pod uwagę alergię, niedobory witaminowo-mineralne, zalecono dodatek do karmy biotyny, kwasów omega-3 i omega-6.
Szpiczak mnogi?
Ze względu na brak poprawy oraz uogólnione powiększenie węzłów chłonnych badania powtórzono miesiąc później, rozszerzając je o dodatkowe parametry. Badanie krwi wykazało podwyższone stężenie białka ogólnego (97 g/l) i fibrynogenu (4,04 g/l) z obniżonym poziomem albumin (20 g/l). Surowica pacjenta została przekazana do badania immunologicznego w celu wykluczenia chorób o charakterze autoagresji (w tym tocznia układowego). W badaniach tych nie stwierdzono obecności przeciwciał przeciwjądrowych ani przeciwko cząsteczkom adhezyjnym naskórka. Elektroforeza białek surowicy wykazała natomiast wysoki wzrost stężenia białka całkowitego, spowodowany hipergammaglobulinemią, co mogło być spowodowane silną stymulacją poliklonalną lub nowotworem szpiku. Zalecono badanie moczu także na obecność białka Bence’a-Jonesa (podejrzenie szpiczaka mnogiego). Stwierdzono obecność w moczu leukocytów oraz świeżych i wyługowanych erytrocytów, białko (2 g/l) pojedyncze nabłonki płaskie, dość liczne wałeczki drobnoziarniste i bakterie oraz nieliczne kryształy szczawianu wapniowego. Stosunek białko : kreatynina wynosił 0,64 (norma do 0,5). Białka Bence’a-Jonesa nie stwierdzono. Elektroforeza białek moczu wykazała nieselektywny białkomocz, w dużej mierze spowodowany albuminurią (62% albumin, stosunek albuminy : globuliny 1,66). W badaniu bioptatu szpiku kostnego plazmocytów nie stwierdzono, RTG kości długich nie wykazało niepokojących zmian.
Zastosowano leczenie objawowe prednizonem w dawce początkowej 30 mg/dzień (masa psa w tym okresie to 34 kg), stopniowo zmniejszonej do 20 mg, a później do 10 mg/dzień.
W kolejnych badaniach krwi stwierdzano niezmiennie hipoalbuminemię, nieznaczny wzrost liczby erytrocytów, któremu w dalszym ciągu towarzyszyła limfopenia oraz granulocytoza. Wciąż utrzymywał się białkomocz, krwiomocz oraz podwyższony stosunek białko : kreatynina w moczu. Wszystkie te parametry ulegały w toku procesu diagnostycznego znacznym wahaniom. Postępowała utrata masy ciała.