W przypadku tej szeroko rozprzestrzenionej na świecie choroby wczesne rozpoznanie ma kluczowe znaczenie.
Pierwotniacze zapalenie mózgu i rdzenia koni (EPM), choroba o podstępnym przebiegu, występuje tam, gdzie konie są narażone na kontakt z pewnymi pierwotniaczymi pasożytami, najczęściej Sarcocystis neurona (w drugiej kolejności Neospora hughesi). Pierwotniaki te zarażają konie i lokalizują się w ośrodkowym układzie nerwowym. Choroba ta jest szeroko rozprzestrzeniona w Ameryce Północnej i Południowej.
EPM może pojawić się o każdej porze roku. Przyjmuje się, że około 50% koni ma kontakt z S. neurona, ale tylko u mniej niż 1% z nich obserwuje się objawy kliniczne. Mimo że EPM rzadko występuje w ogólnej populacji koni, to, jak wynika z badań wykonanych w University of California-Davis (UC Davis), w 14 przypadkach na 10 000 koni rocznie (u 23% koni, które padły z powodu choroby neurologicznej) w OUN wykrywa się przeciwciała przeciw S. neurona.1
Objawy kliniczne
W przebiegu EPM mogą wystąpić bardzo różne objawy kliniczne, zależnie od nasilenia zmian w OUN, co utrudnia odróżnienie tej choroby od innych zaburzeń neurologicznych, takich jak zespół chwiejności, uraz, herpeswirusowa mieloencefalopatia koni, zwyrodnieniowa mieloencefalopatia koni oraz zapalenie mózgu i rdzenia Zachodniego Nilu.
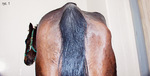
Zależnie od lokalizacji i zasięgu zmian w OUN objawy chorobowe mogą pojawić się nagle lub nasilać się stopniowo. Niektóre objawy mogą być prawie niezauważalne, jak np. ograniczony zanik mięśnia pośladkowego lub mięśnia żwacza. Objawy neurologiczne częściej pojawiają się w postaci ostrej, ale mogą mieć też charakter postępujący, powodując widoczne zaburzenia chodu, zaburzenia czynności jednej lub kilku kończyn, osłabienie, asymetryczny zanik mięśni (ryc. 1 i 2), zaburzenia koordynacji (pochylanie się na jedną stronę), przechylenie głowy, sztywność lub znaczną niezborność, tak że koń może nagle upadać podczas wyścigu lub treningu, bez uprzednich wyraźnie widocznych objawów.
Historia badań nad chorobą
Badania nad występowaniem EPM zaczęły się w 1970 roku. Ich pionierem był J.P. Dubey, PhD, parazytolog i obecnie profesor kontraktowy w Virginia-Maryland Regional College of Veterinary Medicine, Blacksburg, Wirginia, i w Animal Parasitic Diseases Laboratory, Agricultural Research Service, United States Department of Agriculture, Beltsville, Maryland. Prof. Dubey przeprowadził te badania, pracując w Ohio State School of Medicine. Był jednym z pierwszych badaczy, którzy rozpoznali EPM. Choroba ta była początkowo opisywana przez Jamesa Rooneya, DVM, i jego współpracowników jako nietypowy zespół neurologiczny, potem określana jako odcinkowe zapalenie rdzenia.
Od tego czasu notowano przypadki choroby u koni w wieku od 2 miesięcy do 24 lat, zwykle od 1 do 6 lat.2 EPM często występuje u koni ras pełnej krwi angielskiej, standarbred i quarter. Chorobę stwierdzano także u kuców, ale nie obserwowano zachorowań u mułów, osłów i innych koniowatych niebędących końmi.
Etiologia
Konia uważa się za końcowego, przypadkowego żywiciela pośredniego, gdyż choroba nie przenosi się z jednego zwierzęcia na drugie. Żywicielem ostatecznym jest opos, wydalający w kale do środowiska inwazyjne sporocysty, podobne do jajeczek, które są zjadane przez konie pasące się na zakażonych pastwiskach lub wraz z paszą albo wodą. Do żywicieli pośrednich biorących udział w pełnym cyklu rozwojowym S. neurona zalicza się koty domowe, szopy, skunksy, pancerniki i ptaki wróblowe.
Do zakażenia OUN, w tym mózgu i rdzenia kręgowego, dochodzi w wyniku wędrówki sporocyst z przewodu pokarmowego do układu krążenia i przekroczenia bariery krew–mózg. Zarażone konie mogą przejawiać objawy chorobowe wkrótce po inwazji pasożytów, u większości zwierząt nie występują jednak objawy kliniczne ze względu na skuteczną reakcję immunologiczną. Inne konie mogą pozostać nosicielami i objawy mogą u nich wystąpić w późniejszym okresie.
Nicola Pusterela, DVM, PhD, Dipl. ACIVM, profesor nadzwyczajny w Department of Medicine and Epidemiology w School of Veterinary Medicine w UC-Davis, stwierdza: „Można tylko spekulować, czy u konia wystąpi odporność na inwazję pierwotniaków bez pojawienia się objawów chorobowych, czy zwierzę zachoruje wkrótce po zarażeniu, czy też objawy chorobowe uwidocznią się w późniejszym czasie. Tego nie wiemy. Po zarażeniu doświadczalnym u koni szybko pojawiają się objawy chorobowe, ale co dzieje się w warunkach naturalnych, tego nikt nie wie. Przypuszczamy, że u większości koni dochodzi do zarażenia i wytworzenia na tyle skutecznej odporności, że pasożyty nigdy nie docierają do OUN. U pewnego odsetka koni, poniżej 1%, pierwotniaki – prawdopodobnie nie samodzielnie, ale związane z białymi krwinkami – docierają do OUN i tam przechodzą cykle replikacji w komórkach nerwowych, powodując zapalenie i wystąpienie objawów klinicznych”.
Robert MacKay, BVS, PhD, Dipl. ACVIM, profesor zajmujący się chorobami wewnętrznymi i zakaźnymi dużych zwierząt na University of Florida, College of Veterinary Medicine, mówi: „Z tego, co dotychczas wiemy, można sądzić, że na jednego konia z objawami klinicznymi przypada przynajmniej 50 zwierząt, które zostały zarażone, wytworzyły odporność i nigdy nie wystąpiły u nich objawy kliniczne choroby. Bardzo rzadko u zarażonych koni pojawiają się objawy neurologiczne. Konie są względnie odporne na tę chorobę. Osobniki chore to wierzchołek góry lodowej”.
Zdaniem profesora MacKaya nieznane są przyczyny, które powodują, że u jednego na 50 koni występują objawy choroby. W badaniach populacyjnych koni udało się określić pewne czynniki ryzyka, takie jak wiek, przebyte stresujące lub niekorzystnie oddziałujące wydarzenia i przebywanie w środowisku, gdzie liczne są oposy. „Prawdopodobnie istnieje także wpływ genetyczny, który nie został jeszcze dokładnie zbadany. Niektóre konie wydają się bardziej wrażliwe, podczas gdy większość jest oporna na zachorowanie” – stwierdza MacKay.
Fakt, że prawie połowa koni jest narażona na kontakt z pasożytem, ale tylko mniej niż 1% wykazuje objawy kliniczne, może być spowodowany różnicami zdolności inwazyjnych pasożytów lub możliwościami wywołania skutecznej odpowiedzi immunologicznej u poszczególnych koni. Stephen Reed, DVM, z Rood & Riddle Equine Hospital, Lexington, Kentucky, uważa, że prawdopodobne są te dwie odpowiedzi. „W rzeczywistości jednak zakładam, że układ immunologiczny konia odgrywa ważniejszą rolę niż chorobotwórczość pasożyta, nie mamy jednak wystarczającej wiedzy, by ostatecznie stwierdzić, który czynnik jest ważniejszy. Na wszystkich obszarach, gdzie występuje żywiciel ostateczny – opos – obserwuje się w dużym procencie przeciwciała we krwi koni, co wskazuje, że zostały zarażone i wytworzyły te przeciwciała. Ze względu na to, że tylko u niewielu z nich wystąpią objawy neurologiczne, należy zakładać, że są zdolne do pozbycia się pasożyta. Niektórzy jednak twierdzą, że tylko zarażenie bardzo rzadkimi, silnie chorobotwórczymi szczepami powoduje wystąpienie klinicznych objawów EPM. Najprawdopodobniej rację mają obie strony. Według mnie układ immunologiczny odgrywa przy tym decydującą rolę”.
Nikt nie wie, czy istnieją czynniki genetyczne wpływające na zdolności immunologiczne koni. Jennifer Morrow, PhD, współwłaścicielka Equine Diagnostic Solutions (EDS) Laboratory w Lexington, stwierdza: „Na terenie kraju z pewnością występują różne szczepy pasożyta, tak więc konie nie zarażają się tym samym szczepem. Muszą istnieć czynniki po obu stronach, które powodują, że chociaż wiele koni ma kontakt z pasożytem, u bardzo niewielu pojawią kliniczne objawy EPM. Dlaczego tak się dzieje, niestety obecnie nie wiadomo”.
Różne kliniczne objawy neurologiczne choroby, powodujące zaburzenia czynności nerwów, zależą od tego, w którym anatomicznie miejscu pasożyt spowoduje uszkodzenia w OUN (to znaczy w mózgu, rdzeniu kręgowym czy w nerwach obwodowych) i jak ciężkie będą te zmiany. Nasilenie choroby zależy także od kilku innych czynników, takich jak gospodarz, szczep patogenu i prawdopodobnie środowisko. „Jest to bardzo skomplikowane i w rzeczywistości tego nie rozumiemy” – mówi Pusterela.