Pojedyncza próbka rzadko spełnia wszystkie wymagania, z tego względu wskazane jest powtarzane pobieranie próbek z określonego typu zmian (patologa należy wyczerpująco poinformować o umiejscowieniu zmian). Wyjątek stanowią zmiany pęcherzykowe, które należy pobrać jak najszybciej, ponieważ szybko znikają.
Badanie bakteriologiczne z posiewem nie zawsze jest przydatne (z wyjątkiem zakażenia Dermatophilus spp.), ponieważ skóra zasiedlona jest licznymi drobnoustrojami saprofitycznymi. Z drugiej strony także Staphylococcus intermedius jest znaczącym patogenem i przydatne może być oznaczenie antybiogramu dla wszystkich wyhodowanych gatunków bakterii. Wszystkie próbki do posiewów bakteryjnych należy przesyłać na podłożach transportowych. Wymazy na suchych wacikach są nieprzydatne, z wyjątkiem przypadków gdy docierają do laboratorium w bardzo krótkim czasie. Uzyskanie wzrostu bakterii na podłożu zajmuje 1-5 dni, na określenie antybiotykooporności potrzebne są następne 2 dni.
Trzeba także pamiętać, że wiele chorób skóry przebiega ze świądem lub też we wczesnym stadium dochodzi do zakażeń wtórnych, tym samym wynik badania histopatologicznego może być mylący. Z tego względu próbki z pęcherzyków lub krost mają większą przydatność diagnostyczną niż pobrane z owrzodzeń i strupów. W przypadkach zmian przewlekłych, powierzchownych zmian zapalnych lub dermatoz liszajowatych badanie histopatologiczne z reguły nie dostarcza użytecznych informacji.
Biopsja może być wykonana po zastosowaniu urządzeń do poskramiania oraz znieczulenia miejscowego. Wadą znieczulenia miejscowego jest fakt, że może ono prowadzić do uszkodzenia materiału biopsyjnego, szczególnie przy zastosowaniu chlorowodorku lidokainy z adrenaliną. Niektórzy patolodzy uważają jednak, że nie ma to wpływu na jakość próbki, pod warunkiem że środek miejscowo znieczulający zostanie wstrzyknięty podskórnie, a nie śródskórnie. W niektórych przypadkach możliwe jest przeprowadzenie biopsji z wykorzystaniem dutki nosowej lub po wykonaniu sedacji i analgezji z użyciem α-2 agonistów i butorfanolu.
Technika wykonania biopsji
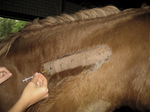
Skóry nie należy golić. W razie potrzeby obszar biopsji należy ostrożnie umyć, nie powinno się jednak trzeć, tak jak w przypadku przygotowania aseptycznego, ponieważ „szorowanie” skóry może spowodować wiele mylących zmian. Do pobierania próbek używa się sztancy biopsyjnej lub ostrza skalpela. Użycie nożyczek może spowodować znaczne artefakty w próbce, powodowane zmiażdżeniem. Próbki płaskopowierzchniowe, w których naskórek zdejmowany jest warstwa po warstwie do powierzchni skóry, wykonuje się bardzo rzadko. W tym przypadku założenie szwów nie jest ani konieczne, ani możliwe.
Biopsję wycinkową (z użyciem sztancy) pobiera się za pomocą jednorazowych próbników (dostępnych w średnicach 4, 6 i 8 mm). Wycinki bardzo małej średnicy mają ograniczoną wartość diagnostyczną. Może także dojść do ich znacznego skręcenia, co utrudnia ich pobranie, jak i dalsze postępowanie. Również w przypadkach gdy pobierana próbka może mieć teoretycznie małą średnicę, lepiej jest pobrać większą, bardziej reprezentatywną. Z tego względu przydatne jest pobranie możliwie największej próbki skóry powiązanej z daną okolicą i stanem chorobowym. W naszej praktyce preferujemy pobieranie wycinków o średnicy 4 mm na obwodowych częściach kończyn oraz głowie i 6 lub 8 mm średnicy na tułowiu. Często wskazane jest pobranie kilku wycinków – zwiększa to szansę stwierdzenia mało nasilonych procesów patologicznych. W celu oddzielenia wycisku od leżącej poniżej tkanki tłuszczowej używa się ostrza skalpela. Absolutnie nie wolno przytrzymywać wycinków pincetą anatomiczną lub chirurgiczną. Pożądane jest także wysyłanie fragmentu tkanki prawidłowej graniczącej ze zmianą, co należy wyraźnie zaznaczyć na pojemniku. W przypadku biopsji wykonywanej z użyciem sztancy, nie zaleca się pobierania próbki w obszarze przejściowym, ponieważ może to powodować, że zmiany umkną uwadze patologa. Nie ma konieczności zszywania miejsca, z którego pobrano próbkę. W warunkach prawidłowych gojenie jest szybkie i zazwyczaj nie pozostawia po sobie blizny.
W przypadku większych zmian, w razie potrzeby wykonuje się biopsję wycinkową. W tym przypadku prowadzi się cięcie przez całą grubość skóry, zarówno przez skórę zmienioną, jak i zdrową – cięcie obejmuje także obszar przejściowy. Miejsce pobrania skóry należy wybrać rozważnie, ponieważ w tym przypadku konieczne jest oczyszczenie rany, a potem założenie szwu. Biopsja wycinkowa jest przydatna także w przypadku pęcherzyków i krost. Wykonuje się cięcie eliptyczne przez wszystkie tkanki, aż do warstwy mięśniowej tkanki podskórnej (panniculus carnosus). Po pobraniu materiału ranę należy oczyścić i zamknąć. Przed przeniesieniem wycinka do roztworu utrwalającego wskazane jest położenie go na minutę na kawałku kartonu, tak aby próbka przykleiła się do papieru. Dzięki temu unika się skręcenia i rolowania próbki w czasie jej utrwalania. Większe próbki należy utrwalić w naturalnym ułożeniu na kartonie. Pomocne są także dostępne w handlu siatki do przenoszenia próbek. Jeżeli występują niejasności co do lokalizacji miejsca wykonania biopsji lub jej rodzaju, należy skonsultować się z patologiem.
Zamknięcia rany w miarę potrzeby dokonuje się za pomocą szwów lub staplera, względnie połączenia obu technik.
Standardowym roztworem utrwalającym jest 4-10-procentowy roztwór formaliny. Niekiedy konieczne może być zastosowanie specjalnych roztworów utrwalających (niezbędna konsultacja z patologiem).
Próbki do badania immunologicznego
Jak dotąd badania immunologiczne próbek pobranych metodą biopsji znajdują się jeszcze w powijakach, zainteresowanie tą metodą rośnie jednak wraz z postępem wiedzy na temat immunologicznych uszkodzeń skóry.
Test śródskórny
Testy śródskórne (ryc. 10) u dużych zwierząt są jeszcze mało wiarygodne i nie są dostępne komercyjnie. Dotychczas niemożliwe jest ustalenie norm dla poszczególnych alergenów u koni (Sloet i wsp., 1998; Lebis, 2002).
Test radioimmunosorbcji (Radio-Allergen-Sorbent-Test, RAST)
Jest to prosty test wykonywany w surowicy. Badanie to pozwala na określenie stężenia swoistych przeciwciał monoklonalnych klasy IgE. Służy ono jako potwierdzenie reakcji alergicznej i logicznym następstwem takiego badania jest wykonanie swoistej szczepionki odczulającej, ukierunkowanej na alergeny wywołujące reakcję. Trudność polega na tym, że badanie takie jest tylko orientacyjne i nie określa precyzyjnie alergenów. Wynik testu wymienia wszystkie alergeny wchodzące w grę. Powoduje to, że roztwory do odczulania zawierają liczne alergeny, co prowadzi niekiedy do rozczarowujących rezultatów. Wiele istotnych alergenów powoduje nieznaczny wzrost przeciwciał IgE, co powoduje, że mogą być one „ukryte” wśród alergenów słabych i wywołujących niewielkie reakcje. Dopóki testy te nie będą pozwalały na jednoznaczną identyfikację alergenów, a sposoby odczulania nie będą precyzyjne i dające zadowalające wyniki, metoda ta nie będzie warta swojej ceny.
Specjalne wskazówki dotyczące przeprowadzania biopsji:
- próbkę należy pobrać ostrożnie, aby uniknąć uszkodzeń powodowanych rozciąganiem i ściskaniem
- w przypadku cięcia skóry należy używać skalpela, a nie nożyczek; te ostatnie powodują znaczne artefakty, szczególnie w przypadku mniejszych próbek
- w celu wyjęcia próbki ze sztancy należy użyć cienkiej igły, w żadnym wypadku nie należy używać pincety powodującej zmiażdżenie tkanek
- próbki należy przyciąć do wielkości < 1 cm, aby umożliwić dobrą penetrację roztworu utrwalającego
- do badania z użyciem mikroskopu elektronowego (np. w przypadku zakażenia wirusem ospy itp.) należy pociąć próbki na kostki o długości boku 1 cm i natychmiast włożyć do aldehydu glutarowego; uprzednio trzeba zarezerwować termin na badanie mikroskopem elektronowym
- hodowla bakterii (lub wirusów) na podłożach z próbek pobranych w czasie biopsji powinna być wykonana tak szybko jak to możliwe. Wymazy i próbki tkanek należy transportować w odpowiednich podłożach i jak najszybciej dostarczyć je do laboratorium
- do badań immunologicznych należy umieścić próbkę na gaziku nasączonym solą fizjologiczną i natychmiast przesłać do laboratorium
Znaczenie eliminacji czynników wywołujących