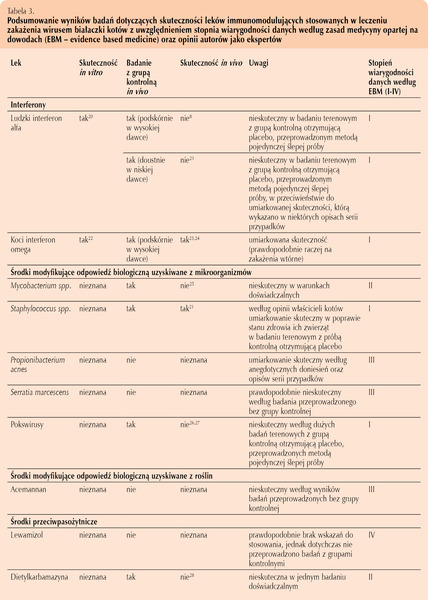
Zydowudyna (AZT – 3’-azydo-2’,3’-dideoksytymidyna) jest rutynowo stosowanym środkiem przeciwwirusowym będącym analogiem nukleozydowym (pochodną tymidyny), blokującym odwrotną transkryptazę retrowirusów. Lek ten skutecznie hamuje replikację FeLV in vitro oraz w warunkach doświadczalnych in vivo. Może zmniejszyć ilość wirusa, usprawnić działanie układu odpornościowego, poprawić stan kliniczny zwierzęcia i jakość życia oraz wydłużyć czas przeżycia kotów zakażonych FeLV. Zydowudynę stosuje się w dawce 5-10 mg/kg m.c. co 12 godzin doustnie lub podskórnie. Wyższe dawki należy podawać ostrożnie, ponieważ istnieje ryzyko wystąpienia działań niepożądanych (np. niedokrwistość nieregeneratywna) (Hartmann, 2005, I stopień EBM).
Raltegrawir – inhibitor integrazy HIV – jest w stanie istotnie hamować replikację FeLV in vitro (Cattori i wsp., 2011). Lek ten jest bardzo dobrze tolerowany przez koty i w ciągu tygodnia prowadzi do znaczącego obniżenia ilości wirusa w organizmie. Niemniej jednak jego działanie nie jest wystarczające, aby umożliwić układowi odpornościowemu zwalczenie wiremii. W związku z tym leczenie musi być kontynuowane przez długi czas, aby utrzymać małą ilość wirusa w organizmie i zapobiec rozwojowi choroby (Boesch i wsp., 2015, III stopień EBM).
Szczepienia
Po opisaniu różnych doświadczalnych szczepionek przeciw FeLV (Jarrett i wsp., 1974, 1975; Pedersen i wsp., 1979) pierwszy preparat wprowadzono na rynek w USA w roku 1984. Chronił on koty przed wiremią, a w jego skład wchodziły standardowo otrzymywane antygeny FeLV (Lewis i wsp., 1981).
Obecnie w Europie dostępnych jest wiele szczepionek przeciw FeLV. W produkcji niektórych z nich wykorzystano technologię rekombinowania DNA, na przykład w tej, która zawiera glikoproteinę otoczki wirusa, a także część białka transbłonowego wytwarzanego przez E. coli (Kensil i wsp., 1991). Była to pierwsza szczepionka przeznaczona dla małych zwierząt, która opierała się na zastosowaniu metod inżynierii genetycznej (Lehmann i wsp., 1991). W innej szczepionce rekombinowanej wykorzystano jako wektor żywy wirus ospy kanarków z wprowadzonymi do niego genami glikoproteiny osłonki wirusa FeLV oraz białka kapsydu (Tartaglia i wsp., 1993). Po podaniu szczepionki ptasi wirus ospy zdolny jest do jednego tylko cyklu replikacji pokswirusa będącego wektorem, ale wystarcza to do ekspresji także wprowadzonych genów FeLV. W przeciwieństwie do innych szczepionek dla kotów nie dochodzi do tu wytworzenia przeciwciał neutralizujących. Działanie ochronne szczepionki prawdopodobnie opiera się na stymulowaniu odporności komórkowej, a przeciwciała neutralizujące produkowane są jedynie wtedy, gdy zaszczepiony kot zetknie się z terenowym FeLV (Hofmann-Lehmann i wsp., 2006).
Różnice pomiędzy dostępnymi na rynku szczepionkami przeciw FeLV są o wiele większe niż w przypadku preparatów przeciwko innym chorobom zakaźnym kotów. Obejmują różnice w działaniu, szczególnie w zakresie skuteczności ochrony, ale również ryzyka działań niepożądanych. Wyniki badań skuteczności tych szczepionek mogą być mylące z uwagi na różne schematy doświadczalne, w tym rasę kotów, drogę zakażenia kontrolnego i wykorzystany do tego szczep bądź kryteria definiujące ochronę (Sparkes, 2003; Torres i wsp., 2010). Dlatego różne badania tej samej szczepionki dawały czasem sprzeczne wyniki. Niezależne badania nad skutecznością pierwszej opisanej szczepionki przeciw FeLV wytworzonej na hodowli komórkowej, a także kilku innych, które nie zostały dopuszczone do obrotu bądź zostały już wycofane z rynku, jednoznacznie dowiodły, że zapewniana przez nie ochrona była niedostateczna.
Kryteria oceny ochrony poszczepiennej określa Farmakopea Europejska. Powszechnym problemem jest tu trudność zakażenia zdrowych kotów kontrolnych jedną dawką doświadczalną, tak by doprowadzić do ich zarażenia. Wspomniane kryteria określają bowiem minimalny odsetek zwierząt kontrolnych, które muszą ulec zakażeniu, aby była pewność, że i u szczepionych doświadczalne zakażenie była wystarczająco silne. Biorąc pod uwagę naturalną oporność kotów na zakażenie FeLV, należy uwzględnić proporcję przypadków, w których nie doszło do zakażenia pomimo ekspozycji na zarazek („preventable fraction”) (Scarlett i Pollock, 1991).
Niektóre badania opierały się na „naturalnym” narażeniu na kontakt z FeLV – poprzez zapewnienie szczepionym kotom kontaktu z osobnikami wiremicznymi. Nie jest to zgodne z wytycznymi Farmakopei Europejskiej, naśladuje jednak naturalną drogę zakażenia, która zwykle nie polega na jednorazowej intensywnej ekspozycji, ale na długotrwałym kontakcie z wirusem przez pewien czas. W opinii ekspertów bytowanie zaszczepionych kotów ze zwierzętami trwale wiremicznymi jest bardziej realistycznym sposobem oceny skuteczności szczepionki w warunkach terenowych.
Wiele badań wykazało, że żadna szczepionka przeciwko FeLV nie zapewnia pełnej ochrony przed zachorowaniem (100% skuteczności) ani nie chroni przed zakażeniem bezobjawowym. U zaszczepionych kotów, które następnie miały kontakt ze zjadliwym wirusem FeLV, można było znaleźć prowirusowe DNA i wirusowe RNA we krwi, aczkolwiek w ilościach bardzo małych w porównaniu z naturalnie zakażonymi trwale wiremicznymi kotami (Hofmann-Lehmann i wsp., 2007, III stopień EBM). Wyniki tych doświadczeń potwierdziły, że szczepienie przeciw FeLV nie jest w stanie zapewnić „sterylnej” odporności (niedopuszczającej zarazka do organizmu) ani nie chroni przed zakażeniem bezobjawowym. Niemniej jednak większość zaszczepionych kotów jest chroniona przed postępującym zakażeniem (trwałą wiremią) i rozwojem wynikającej z tego choroby.
Tylko jedno badanie po dootrzewnowym kontrolnym zakażeniu FeLV dowiodło braku obecności antygenu p27, wirusowego RNA i prowirusowego DNA u większości kotów zaszczepionych jednym z dwóch preparatów zawierających inaktywowany wirus (Torres i wsp., 2010).
Generalnie uznaje się, że szczepienie przeciw FeLV powinno obejmować koty wychodzące na zewnątrz. Zapewnienie im ochrony przed tym śmiertelnym zakażeniem jest w tej grupie jak najbardziej uzasadnione, gdyż korzyści zdecydowanie przeważają nad ryzykiem działań niepożądanych. Gdy jednak prawdopodobieństwo kontaktu z FeLV uznaje się za bliskie zeru, nie zaleca się szczepienia. W podejmowaniu decyzji co do konieczności szczepienia pomocne może być uwzględnienie różnic w rozpowszechnieniu FeLV w różnych rejonach geograficznych. W niektórych krajach Europy udało się niemal wyeliminować ten zarazek, możliwe jest jednak istnienie różnic w jego występowaniu pomiędzy poszczególnymi obszarami w danym kraju. Istotnym czynnikiem jest także to, czy kot jest/będzie zwierzęciem wychodzącym na zewnątrz. Jeżeli istnieje pewność, że kot nie będzie narażony na kontakt z FeLV, wówczas szczepienie nie jest konieczne. Niemniej jednak należy pamiętać, że okoliczności te mogą ulec zmianie – właściciel może się przeprowadzić wraz z kotem albo kot może zmienić dom. Taką ewentualność powinno się brać pod uwagę, szczególnie w przypadku pierwszej wizyty kociąt związanej ze szczepieniem.
W ciągu ostatnich 20 lat wykazano związek pomiędzy podawaniem szczepionek przeciw FeLV (oraz wściekliźnie) a późniejszym rozwojem mięsaka wywodzącego się z tkanek miękkich w miejscu iniekcji, tak zwanego mięsaka poiniekcyjnego kotów (Hendrick i wsp., 1992; Kass i wsp., 1993; Hendrick i wsp., 1994; Macy, 1995; Kass i wsp., 2003; Dean i wsp., 2006; Hartmann i wsp., 2015). W przeciwieństwie do włókniakomięsaków wywoływanych przez FeSV, mięsak poiniekcyjny kotów ma inny obraz histopatologiczny (Doddy i wsp., 1996; Madewell i wsp., 2001) i jest złośliwy (Hendrick i wsp., 1994), a współczynnik dla przerzutów, głównie do płuc, zawiera się w przedziale od 10 do 28% (Sandler i wsp., 1997; Couto i Macy, 1998; Hershey i wsp., 2000; Kobayashi i wsp., 2002).
Mięsak poiniekcyjny kotów jest trudny w leczeniu, wymaga radykalnego wycięcia chirurgicznego, najlepiej połączonego z radioterapią, chemioterapią oraz dodatkową immunoterapią (Hirschberger i Kessler, 2001; Jahnke i wsp., 2007; Huttinger i wsp., 2008; Jas i wsp., 2015). Obecnie za najbardziej wiarygodną uznaje się hipotezę, że w patogenezie tego guza przewlekłe zapalenie w miejscu iniekcji stanowi bodziec dla transformacji nowotworowej komórek. Wydaje się, że stosowanie szczepionek zawierających adiuwanty jest obarczone większym ryzykiem rozwoju mięsaka poiniekcyjnego kotów, z uwagi na to, że po podaniu tych preparatów obserwuje się silniej wyrażoną miejscową odpowiedź zapalną. A zatem w kontekście ryzyka rozwoju tego nowotworu należy używać tych szczepionek przeciwko FeLV, które powodują najsłabszą reakcję zapalną tkanki podskórnej, a więc raczej szczepionek bez adiuwantów niż zawierających adiuwant (Hartmann i wsp., 2015).
Pierwsze szczepienie
Wszystkie koty narażone na kontakt z FeLV powinny zostać zaszczepione, najlepiej już w wieku 8-9 tygodni i ponownie w 12. tygodniu życia, razem z innymi szczepieniami (Brunner i wsp., 2006). Pierwszy cykl szczepień obejmuje także dodatkową dawkę szczepionki podaną rok później. Łączenie różnych szczepionek w jednej strzykawce jest możliwe jedynie gdy producent dopuszcza taką ewentualność w kraju, w którym zarejestrowana jest szczepionka. Z tego względu należy zapoznać się z regulacjami obowiązującymi lekarza weterynarii w danym kraju.
Jeżeli stan zakażenia FeLV u kota nie jest znany, powinno się przed szczepieniem zbadać go w tym kierunku „szybkim testem” ELISA lub immunochromatograficznym, a najlepiej również metodą PCR w kierunku DNA prowirusa. Pozwoli to uniknąć niepotrzebnego szczepienia w sytuacji gdy powyższe testy wyjdą dodatnio. Jeżeli natomiast zakażenie FeLV przed szczepieniem jest mało prawdopodobne (np. u potomstwa niezakażonych rodziców, które nie miało kontaktu z zakażonymi kotami), przeprowadzenie powyższych badań może nie być konieczne.














