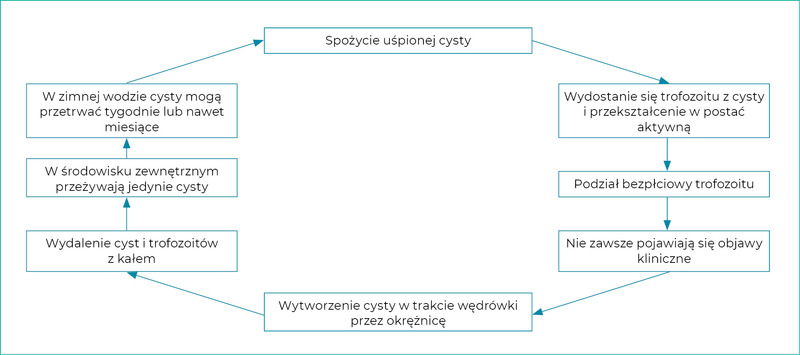
Do badania odchodów zaleca się metodę flotacji z siarczanem cynku. Wydalanie cyst jest okresowe, dlatego należy zbadać kilka (zwykle trzy) próbek kału (pobieranych codziennie lub co drugi dzień). Rutynowe metody z użyciem soli nasyconej albo sacharozy nie są odpowiednie, ponieważ prowadzą do zniekształcenia cyst. Możliwe jest również zastosowanie techniki barwienia bezpośredniego z wykorzystaniem przeciwciał znakowanych fluoresceiną do wykrywania cyst w rozmazach kału, chociaż test ten jest rzadko stosowany w Europie.
Dostępne są techniki ELISA do wykrywania antygenu w kale, w tym SNAP test (IDEXX Ltd.), ale metody te nie wydają się bardziej czułe niż staranne badanie przesiewowe kału (Barr i wsp., 1992). Badania wykazały, że wykrywanie antygenu metodą ELISA dobrze koreluje z wynikami badania z wykorzystaniem przeciwciał znakowanych fluoresceiną (Cirak i Bauer, 2004).
Testy PCR są dostępne, ale nie są szeroko stosowane. Mają tę zaletę, że są w stanie zidentyfikować podtyp występujący u pacjenta. Pierwsze badania PCR ujawniły wysoki odsetek wyników dodatnich (do 80%), co wzbudziło obawy, że wykrywają inwazje niemające znaczenia klinicznego (McGlade i wsp., 2003). Obecnie jednak do wykrywania Giardia dostępne są ilościowe testy PCR w czasie rzeczywistym (Real Time PCR), a ich wyniki są podobne do tych otrzymywanych za pomocą innych technik (Yang i wsp., 2015).
W przeszłości standardowym testem była metoda flotacji kału, ale test na obecność antygenu w kale w praktyce wydaje się równie czuły i swoisty, a także wygodny do wykonania. Badanie rozmazów kału jest tanie i ma tę zaletę, że umożliwia identyfikację ewentualnych innych pasożytów, ale jest mniej czułe, więc w praktyce jest rzadziej wykonywane (Olson i wsp., 2010).
Pragmatyczne podejście, często stosowane przez praktyków jako alternatywa dla badań laboratoryjnych, polega na ocenie reakcji na leczenie. Należy jednak unikać takiego postępowania ze względu na ryzyko zmiany flory jelitowej w wyniku podawania antybiotyków. Ponadto często występują równoczesne inwazje innych pasożytów, takich jak Tritrichomonas foetus czy Cryptosporidium, a leczenie w razie potrzeby należy dostosować do uzyskanych wyników badań.
Leczenie
W zwalczaniu giardiozy stosowano na ogół lek z grupy imidazoli – fenbendazol, zwykle podawany w dawce 50 mg/kg m.c. przez 5-7 dni (Barr i wsp., 1994; Keith i wsp., 2003). Fenbendazol może być stosowany u ciężarnych samic. Alternatywą jest metronidazol. Pierwotnie zalecano stosowanie go w dawce 50 mg/kg m.c. przez pięć dni. Tego leku nie powinno się jednak podawać w okresie ciąży. Ponadto taka dawka wiąże się ze zwiększonym ryzykiem działań niepożądanych – toksyczności dla ośrodkowego układu nerwowego powodującej osłabienie, niezborność, dezorientację i drgawki.
Ze względu na możliwość pojawienia się oporności na środki przeciwbakteryjne i pasożytobójcze nie zaleca się leczenia kotów bez objawów, a jedynie z dodatnim wynikiem testu w kierunku Giardia, zwłaszcza metronidazolem lub fenbendazolem.
Ostatnio zasugerowano, że dzienna dawka 25 mg/kg m.c. jest skuteczna, a prawdopodobieństwo wystąpienia skutków ubocznych jest małe. W niektórych uporczywych inwazjach obejmujących wiele kotów skuteczne może być podanie fenbendazolu i metronidazolu jednocześnie. Sugerowano jednak, że ponowne leczenie fenbendazolem może nasilać powstawanie oporności E. coli na antybiotyki (Tysnes i wsp., 2016).
Alternatywą jest użycie ronidazolu, który okazał się skuteczny przy giardiozie u psów (Fiechter i wsp., 2012) i kotów (Zanzani i wsp., 2016). Ronidazol jest obecnie stosowany również w zwalczaniu zarażenia Trichomonas foetus u kotów.
Generalnie nie zaleca się leczenia kotów niewykazujących objawów klinicznych, ale w środowiskach zamieszkiwanych przez wiele kotów, które mają objawy, skuteczniejsze może być leczenie wszystkich zwierząt (psów i kotów) mieszkających razem (zalecenie ESCCAP). Ponadto należy leczyć zarażone koty mające kontakt z osobami z obniżoną odpornością.
Oprócz leczenia chorych kotów niezwykle ważne jest odpowiednie postępowanie w stosunku do skażonego środowiska w celu zapobiegania superinwazji i ponownemu zarażeniu po leczeniu.
Zapobieganie i higiena
W skażonym środowisku dokładne czyszczenie i stosowanie 4-chloru-m-krezolu (chlorokrezolu) lub czwartorzędowych związków amoniowych skutecznie zapobiega ponownemu zarażeniu i rozprzestrzenianiu się inwazji w obiektach utrzymujących wiele kotów. Odchody zarażonych zwierząt należy zniszczyć, a miski oraz powierzchnie oczyścić i zdezynfekować czwartorzędowymi związkami amoniowymi. Jeżeli to możliwe, w uniknięciu ponownego zarażenia może również pomóc przeniesienie kota do innego pomieszczenia. Mycie/kąpanie zwierząt lub przynajmniej oczyszczanie okolic odbytu szamponem zawierającym chloroheksydynę przed i po leczeniu może pomóc w eliminacji cyst.
Wskazane jest też wykonywanie testów przed wprowadzeniem nowych zwierząt do środowiska zamieszkiwanego przez inne koty, aby uniknąć przeniesienia pasożyta. Można zrobić to w okresie kwarantanny. Personel specjalistyczny (lekarze weterynarii, studenci, pielęgniarki, technicy weterynarii) powinien znać zasady higieny i ich przestrzegać.
W USA stosowano dawniej szczepionkę opartą na inaktywowanych trofozoitach (w Europie nie była dopuszczona), ale nie jest już ona dostępna. Była używana zarówno w leczeniu, jak i w profilaktyce.
Ryzyko zoonotyczne
W wielu europejskich badaniach przeprowadzonych w Niemczech, we Włoszech, w Hiszpanii, Grecji i Polsce wykazano u kotów obecność podgrupy A (Paoletti i wsp., 2010; Dado i wsp., 2012; Sotiriadou i wsp., 2013; Zanzani i wsp., 2014; Pallant i wsp., 2015; Piekarska i wsp., 2016; Kostopoulou i wsp., 2017; Gil i wsp., 2017), występującego samodzielnie lub jako podwójna inwazja (podtypy A i F; Dado i wsp., 2012). Genotyp B również został zidentyfikowany u kotów (Pallant i wsp., 2015; Kostopoulou i wsp., 2017), ale według różnych badań europejskich i kanadyjskich najbardziej rozpowszechniona jest podgrupa A (McDowall i wsp., 2011). Wydaje się, że ryzyko przenoszenia zoonotycznych Giardia jest większe u młodych kotów, w wieku poniżej roku, niż u zwierząt starszych.
W ostatnim badaniu u trzech psów i dwóch kotów z dodatnim wynikiem testu na obecność Giardia, mieszkających w regionie Alava w Hiszpanii, nie wykryto odzwierzęcych giardii. Sugeruje to, że przenoszenie tych pierwotniaków przez zwierzęta w domach jest rzadkie, o ile w ogóle występuje. W tym badaniu nie wykazano jednoczesnych inwazji G. duodenalis u ludzi i psów/kotów, chociaż 29% (16/55) psów i 5,9% kotów miało wynik dodatni (de Lucio i wsp., 2017). Obecność podgrupy odzwierzęcej A wykryto u kotów w schronisku w tym samym regionie (Gil i wsp., 2017). Z drugiej strony badanie przeprowadzone u dzieci mieszkających w złych warunkach środowiskowych na Słowacji wykazało, że u ludzi w Europie występuje swoisty dla kotów podtyp F (Pipikova i wsp., 2018).