Wytyczne te zostały po raz pierwszy opublikowane przez Thiry i wsp. w „Journal of Feline Medicine and Surgery” (11, 2009, 615-618). Całkowicie nowa wersja została opracowana przez prof. Tadeusza Frymusa i wsp. i opublikowana w „Viruses” 13 (2021), 1435. Po pojawieniu się ognisk ptasiej grypy u kotów w Polsce w 2023 roku Światowa Organizacja Zdrowia Zwierząt, przy udziale ABCD, opracowała arkusz informacyjny z najczęściej zadawanymi pytaniami. Niniejsza aktualizacja została opracowana przez prof. Tadeusza Frymusa i wsp. ABCD.
Wprowadzenie
Grypa jest wysoce zaraźliwym, ostrym zakażeniem, zwykle górnych dróg oddechowych, wykrywanym na całym świecie u wielu kręgowców (Krammer i wsp., 2018). Choroby układu oddechowego kotów wywoływane przez wirusy grypy wydają się raczej rzadkie i zazwyczaj ustępują samoistnie, wtórne zakażenia bakteryjne mogą jednak prowadzić do powikłań, w tym śmierci. Bardzo rzadko wysoce zjadliwe wirusy grypy mogą wywoływać u kotów ciężką, uogólnioną chorobę wirusową o wysokiej śmiertelności (Thiry i wsp., 2007).
Właściwości wirusa grypy
Wirus grypy należy do rodziny Orthomyxoviridae. Znane są cztery typy wirusa (A, B, C i D). Wirus grypy typu A (ang. influenza virus type A, IAV) odgrywa główną rolę, gdyż powoduje masowe zachorowania u ludzi na całym świecie, a także u zwierząt, w tym ptaków, koni, świń, norek, fretek, nietoperzy i ssaków morskich. Choroba może dotknąć również psy i koty.
Wirusy typu A (IAV) są klasyfikowane jako podtypy na podstawie antygenowości dwóch białek powierzchniowych wirusa – hemaglutyniny (H) i neuraminidazy (N). Istnieje 16 antygenów H i dziewięć antygenów N (Krammer i wsp., 2018), a ich różne kombinacje dają 144 podtypy IAV (na przykład H1N1, H3N8, H5N2 itp.). Ponadto u nietoperzy wykryto kolejne podtypy wirusów grypopodobnych (H17N10 i H18N11), wydają się one jednak różnić od konwencjonalnych wirusów IAV pod wieloma względami (Yang i wsp., 2021). Zaproponowano też nowy podtyp H (H19) (Fereidouni i wsp., 2023).
Wirusy grypy są genetycznie bardzo zmienne, szybko zmieniają swoje antygeny, zjadliwość i zdolność do replikacji u nowych gatunków żywicieli (Wille i Holmes, 2020). Odpowiadają za to dwa mechanizmy – dryf antygenowy i przesunięcie antygenowe. Dryf antygenowy wynika z mutacji genów kodujących białko N lub H, powodujących powstanie nowego wariantu antygenowego danego podtypu. Jeżeli replikacja takiego wariantu nie jest wystarczająco skutecznie hamowana przez układ odpornościowy gospodarza, który wyeliminował zakażenie wywołane przez pierwotny szczep, zmutowany wirus może ponownie zakazić tę samą populację. Z kolei przesunięcie antygenowe prowadzi do nagłego pojawienia się nowego podtypu wynikającego z wymiany (reasortacji) fragmentów RNA między dwoma lub więcej podtypami IAV replikującymi się w tym samym czasie u gospodarza (Wille i Holmes, 2020). Dobrze znanymi „zbiornikami mieszania” dla wirusów IAV człowieka są świnie i ptaki, ale wyniki badań sugerują, że rolę tę mogą również pełnić psy i koty (Chen i wsp., 2018; Zhao S i wsp., 2020). Te nowe podtypy, które mają właściwości patogenne wspólne ze szczepami macierzystymi i zawierają mieszankę antygenów powierzchniowych pierwotnych szczepów, mogą być bardzo niebezpieczne. Jako że populacja gospodarzy docelowych jest często nieuodporniona na nowy podtyp, w przeszłości dochodziło do epidemii, a nawet pandemii wśród różnych gatunków zwierząt i ludzi (Krammer i wsp., 2018). W wyniku dalszej selekcji (poprzez dryf antygenowy) nowy podtyp może ewoluować w wiele wariantów antygenowych (He i wsp., 2019). Wszystkie te mechanizmy powodujące różnorodność antygenową przyczyniają się do stałego krążenia wirusów IAV w populacjach ptaków i ssaków.
Wirusy grypy są szybko inaktywowane przez promieniowanie UV, detergenty i środki dezynfekujące. Wirusy IAV pozostają jednak zakaźne w wodzie przez tygodnie lub miesiące, w zależności od pH, zasolenia i temperatury (Irwin i wsp., 2011; Keeler i wsp., 2012).
Epidemiologia
Spośród 144 możliwych podtypów wirusa IAV zdecydowana większość została wykryta u ptactwa wodnego (zwłaszcza kaczek, gęsi i łabędzi), które jest jego naturalnym żywicielem (Sonnberg i wsp., 2013). Ptaki, które często są bezobjawowymi nosicielami wirusa, mogą również wydalać wirusy grypy wraz z odchodami, a ich sezonowe migracje mają kluczowe znaczenie dla rozprzestrzeniania się tych zarazków na całym świecie (ryc. 1). Wirusy te mogą zimować w lodzie (na przykład w jeziorach północnych), co pozwala na ponowne pojawienie się grypy w kolejnym sezonie.
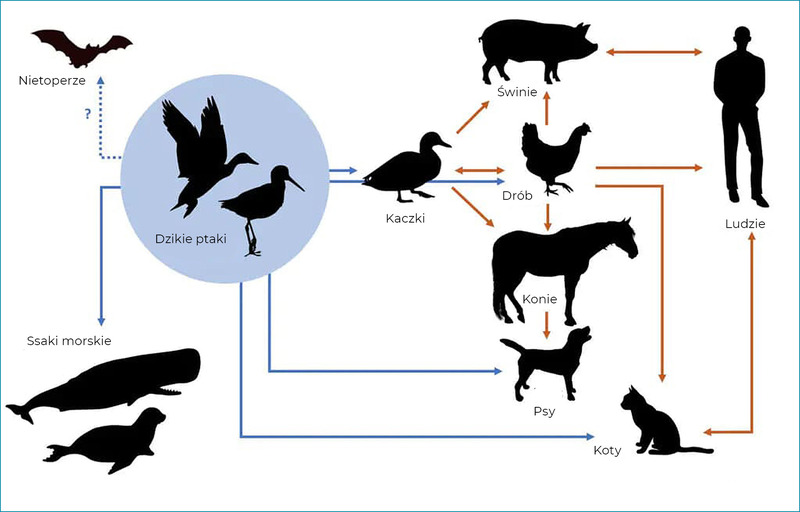
Ogólnie rzecz biorąc, wirusy IAV izolowane od danego gatunku są w stanie skutecznie namnażać się jedynie w tym gospodarzu. Dlatego też powszechnie stosowane są terminy: „grypa człowieka”, „ptasia grypa”, „końska grypa” itd. Ich duża zmienność genetyczna ułatwia jednak adaptację do innych gatunków żywicieli, wywołując u nich nowe ogniska grypy. Przykładami takich zjawisk są: dobrze udokumentowane wystąpienie epidemii grypy człowieka, która wybuchła wśród świń (Krammer i wsp., 2018), ogniska grypy psów wywołane przez wirusa grypy koni H3N8 IAV (Crawford i wsp., 2005; Crawford i wsp., 2011), a także kilka ognisk u różnych gatunków ssaków, w tym psów i kotów, wywołanych przez wirusy grypy ptaków (Song i wsp., 2008; Newbury i wsp., 2017).
Z drugiej strony zmienność wirusa powoduje nie tylko pojawianie się jego nowych wariantów, ale także zanikanie tych już znanych, takich jak wirus grypy koni H7N7, który od 1979 roku nie został nigdzie wyizolowany od koni (Webster, 1993), oraz wirus grypy psów H3N8, który krążył nieprzerwanie wśród psów w Stanach Zjednoczonych przez 15 lat, ale od 2016 roku wykryto go tylko u nielicznych osobników (Wille i Holmes, 2020).
Patogeneza
Większość wirusów grypy wywołuje ostre zakażenia górnych dróg oddechowych, które ustępują samoistnie lub przebiegają bezobjawowo (Krammer i wsp., 2018). Chociaż zakażenie IAV może prowadzić do wtórnych zakażeń bakteryjnych albo innych powikłań, wirusy te są znane jako „szczepy nisko zjadliwe”. U ludzi, koni, świń, psów i niektórych innych gatunków replikują się one wyłącznie w górnych drogach oddechowych, wywołując powszechnie występującą grypę „sezonową”. Po okresie inkubacji, który trwa od jednego do kilku dni, zapalenie błony śluzowej oskrzeli prowadzi do zmian martwicowych i wysięku, a w płucach do przekrwienia. W większości przypadków do wyzdrowienia dochodzi w ciągu 1-3 tygodni, ale czasem powikłania bakteryjne mogą prowadzić do zapalenia płuc. Zdarza się to szczególnie w przypadku złych warunków, stresu, w szczególności u bardzo młodych i starszych osobników. Przy większości zakażeń śmiertelność wynosi poniżej 1% (Wasik i wsp., 2021). Tego rodzaju grypa występuje u kotów bardzo rzadko (Song i wsp., 2011; Fiorentini i wsp., 2011; Jeoung i wsp., 2013). Eksperymentalne zakażenie kotów wirusami grypy o niskiej zjadliwości prawie nigdy nie wywołuje choroby, ale zwykle przez kilka dni dochodzi do replikacji wirusa i subklinicznej infekcji (Paniker i Nair, 1970; Romváry i wsp., 1975; Hinshaw i wsp., 1981). Natomiast wysoce zjadliwe wirusy grypy, występujące głównie u ptaków, mogą replikować się nie tylko w drogach oddechowych, ale także w przewodzie pokarmowym, mięśniach, sercu, mózgu i innych narządach, powodując ostrą chorobę ogólnoustrojową, często o wysokiej śmiertelności. Te wirusy wywołują nagłą, masową śmiertelność kurcząt, indyków i innych ptaków, ale zakażenia subkliniczne są również powszechne u dzikich ptaków. U ssaków ten typ grypy występuje bardzo rzadko. Jednakże w latach 1918-1920 światowa pandemia „hiszpanki”, która spowodowała śmierć około 20-40 milionów ludzi, została wywołana przez wysoce zjadliwego wirusa grypy H1N1. Wysoce zjadliwy wirus grypy ptaków H5N1 również może wywoływać ciężką chorobę ogólnoustrojową u kotów po okresie inkubacji trwającym 1-2 dni (Kuiken i wsp., 2004). Wirus wydalany jest przez drogi oddechowe i kał począwszy od trzeciego dnia po zakażeniu i trwa to minimum cztery dni (Rimmelzwaan i wsp., 2006). Replikacja tego wirusa po zakażeniu kota drogą pokarmową, a niewykluczone, że również drogą oddechową, rozpoczyna się najprawdopodobniej w przewodzie pokarmowym i/lub górnych drogach oddechowych, a następnie w płucach, powodując ogniskowe uszkodzenia pęcherzyków płucnych (van Riel i wsp., 2006). Wirus ostatecznie dociera do wątroby, serca, mózgu, kłębuszków nerkowych, kory nadnerczy, a czasami też do śledziony, trzustki i jelita grubego (Rimmelzwaan i wsp., 2006; Songserm i wsp., 2006; Yingst i wsp., 2006). U niektórych kotów domowych lub dzikich kotowatych zaobserwowano nieropne martwicowe zapalenie mózgu i zaburzenia aparatu nerwowo-mięśniowego jelit (Keawcharoen i wsp., 2004; Rimmelzwaan i wsp., 2006). Ostra śmiertelność związana jest z wystąpieniem licznych krwotoków, zapalenia naczyń, zakrzepicy i martwicy w różnych narządach, a także zapalenia oskrzeli i śródmiąższowego zapalenia płuc z zastojem płucnym (Reperant i wsp., 2012, Sillman i wsp., 2023).
Zakażenia IAV u kotów
Przez długi czas uważano, że koty są odporne na zakażenie wirusem grypy. Obecnie jednak wiadomo, że koty, psy, fretki i inne zwierzęta mięsożerne uczestniczą w globalnym krążeniu wirusów IAV (Wasik i wsp., 2021).
Nisko zjadliwe wirusy grypy IAV
Pierwsze badania wykazały, że koty są podatne na niektóre wirusy grypy izolowane od ludzi, ptaków i fok, wywołujące zazwyczaj jedynie zakażenia subkliniczne lub łagodną gorączkę (Paniker i Nair, 1970; Romváry i wsp., 1975; Hinshaw i wsp., 1981). Ponadto wirus grypy psów może czasami przenosić się na koty. W 2002 roku miał miejsce pierwszy wybuch ciężkiej grypy u psów rasy foxhound angielski, wywołany przez wirusa grypy koni H3N8 (Daly i wsp., 2008). Badania serologiczne wykazały, że ten zarazek psiej grypy krążył wśród chartów wyścigowych w Stanach Zjednoczonych od początku XXI wieku (Anderson i wsp., 2012). Po wybuchu epidemii na Florydzie wirus rozprzestrzenił się na inne rasy i regiony USA, szczególnie w schroniskach (Crawford i wsp., 2005; Payungporn i wsp., 2008; Rivailler i wsp., 2010).
Podobny przypadek międzygatunkowego przeniesienia wirusa H3N8 został odnotowany podczas epidemii grypy koni w Australii w 2007 roku, kiedy wirusem końskim zostały zakażone psy (Crawford i wsp., 2011). Jak dotąd nie stwierdzono możliwości zakażenia kotów wirusem grypy koni H3N8 w środowisku naturalnym. Natomiast w przypadku eksperymentalnego zakażenia koty chorują, wydalają wirusy i w wyniku kontaktu bezpośredniego są źródłem zakażenia dla innych kotów (Su i wsp., 2014).













