W Korei Południowej i w Chinach w latach 2004-2005 u psów pojawił się wirus grypy H3N2, który najprawdopodobniej pochodził od ptaków (Song i wsp., 2008; Zhu i wsp., 2015). Od 2015 roku w Stanach Zjednoczonych i w Kanadzie pojawiło się kilka ognisk tej psiej grypy w wyniku przeniesienia wirusa przez psy uratowane z azjatyckich ferm mięsnych (Voorhees i wsp., 2017; Wasik i wsp., 2021). Przenoszenie tego wirusa także między innymi gatunkami jest możliwe, co wykazały eksperymentalne zakażenia fretek, kawii domowych i kotów (Kim i wsp., 2013). Ponadto w dwóch schroniskach odnotowano u kotów ogniska tej grypy objawiającej się gorączką, przyspieszonym oddechem, kichaniem, kaszlem, dusznością i sennością (Song i wsp., 2011; Jeoung i wsp., 2013). W jednym z tych schronisk zachorowalność u kotów wynosiła 100%, a śmiertelność 40%. Chociaż do zakażenia u kotów może dojść poprzez kontakt bezpośredni pies–kot lub kot–kot, oczywiste wydaje się, że replikacja wirusa zachodzi mniej efektywnie u kotów niż u psów, jako że ogniska choroby u kotów są bardzo rzadkie. Ogniska te były w większości ograniczone do schronisk, a wirus raczej nie jest długotrwale przenoszony wśród kotów domowych (Voorhees i wsp., 2017).
W latach 2016-2017 doszło do zakażenia kotów wirusem ptasiej grypy H7N2 w schronisku w Nowym Jorku. Wirus następnie szybko rozprzestrzenił się na inne schroniska w Nowym Jorku i Pensylwanii, prawdopodobnie na skutek przemieszczania kotów pomiędzy schroniskami (Newbury i wsp., 2017; Blachere i wsp., 2018). Wirus łatwo szerzył się między kotami, ale już nie pomiędzy psami, kurczakami ani królikami przebywającymi w tych samych placówkach (Lee i wsp., 2017). Łącznie zakażonych zostało około 500 kotów. Większość z nich miała łagodne objawy ze strony układu oddechowego (Hatta i wsp., 2018). U jednego starszego kota z chorobami współistniejącymi stwierdzono ciężkie zapalenie płuc i został on poddany eutanazji. Ponadto w wyniku wielokrotnego bezpośredniego kontaktu z kotami zakażeniu ulegli lekarz weterynarii i pracownik schroniska, którzy nie stosowali środków ochrony osobistej. Przejściowo wystąpiły u nich łagodne objawy choroby układu oddechowego (Belser i wsp., 2017).
Zakażenia eksperymentalne potwierdziły, że koty są wrażliwe na wirusa grypy człowieka H3N2, który odpowiadał za wybuch pandemii grypy „Hong-Kong” w 1968 roku (Paniker i Nair, 1970). Ponadto w kilku badaniach wykazano, że koty (i psy) na całym świecie mogły zostać zakażone wirusem H1N1 podczas kolejnej pandemii grypy człowieka w 2009 roku lub później, prawdopodobnie poprzez bezpośredni kontakt z chorymi właścicielami (Löhr i wsp., 2010; Sponseller i wsp., 2010; Ali i wsp., 2011; Campagnolo i wsp., 2011; Pigott i wsp., 2014; Zhao FR i wsp., 2014; Tangwangvivat i wsp., 2019; Zhao S i wsp., 2020; Duijvestijn i wsp., 2024). We Włoszech wirus ten spowodował nagłe pojawienie się u 90 kotów choroby z objawami oddechowymi i żołądkowo-jelitowymi, w wyniku której zmarło 25 zwierząt (Fiorentini i wsp., 2011). Podejrzewano przenoszenie wirusa między kotami (van den Brand i wsp., 2010; Fiorentini i wsp., 2011).
Istnieją również doniesienia o sporadycznych przypadkach grypy u kotów wywołanej przez inne wirusy (Cao i wsp., 2017; Borland i wsp., 2020; Wasik i wsp., 2021). U kotów przebywających w europejskich schroniskach obecność przeciwciał przeciwko IAV ptaków i ludzi nie należy do rzadkości (Zhao S i wsp., 2020). W ich surowicy można wykryć przeciwciała przeciwko hemaglutyninom (H) H1, H3, H5, H7 i H9.
Wysoce zjadliwy wirus ptasiej grypy H5N1
W Azji w 1996 roku pojawił się wysoce zjadliwy wariant wirusa grypy ptaków (ang. highly pathogenic avian influenza, HPAI) H5N1, który spowodował epidemię „ptasiej grypy” o wysokiej śmiertelności. W ramach jej zwalczania zlikwidowano setki milionów sztuk drobiu (Webster i wsp., 2005), ale z powodu migracji dzikiego ptactwa epidemia ta nadal się rozprzestrzenia. Od 2003 roku wirus ten spowodował niezliczone ogniska wysoce zjadliwej grypy ptaków, początkowo niszcząc hodowle drobiu w Azji Południowo-Wschodniej, a następnie rozprzestrzeniając się na Europę, Afrykę i ostatnio także na obie Ameryki (Wille i Barr, 2022). Ssaki chorowały sporadycznie, w tym 939 osób (od 01.01.2003 roku do 27.09.2024 roku), ale śmiertelność u ludzi wyniosła prawie 50% (Światowa Organizacja Zdrowia, 2024). Ciężkie przypadki choroby odnotowano również u kotów domowych (Kuiken i wsp., 2004; Thiry i wsp., 2007), a także u tygrysów i lampartów trzymanych w ogrodach zoologicznych w Tajlandii i karmionych świeżymi tuszami kurcząt (Keawcharoen i wsp., 2004). W przypadku jednego ogniska choroby podejrzewano przenoszenie się choroby między tygrysami (Thanawongnuwech i wsp., 2005).
Pojedyncze zachorowania u kotów domowych odnotowano też w Europie i Stanach Zjednoczonych (Thiry i wsp., 2007; Briand i wsp., 2022, Sillman i wsp., 2023), jak również zakażenia subkliniczne (Leschnik i wsp., 2007; Moreno i wsp., 2023). Zazwyczaj były one związane z zakażonymi dzikimi ptakami lub drobiem. Zakażenia eksperymentalne potwierdziły, że wysoce zjadliwy wirus grypy ptaków H5N1 może wywoływać ciężką, śmiertelną chorobę u kotów domowych i przenosić się przez kontakt bezpośredni między nimi (Kuiken i wsp., 2004; Rimmelzwaan i wsp., 2006; Vahlenkamp i wsp., 2008). Wirus jest wydalany nie tylko przez drogi oddechowe, ale także z kałem.
Uważa się, że nawet na obszarach, na których ptaki są zakażone wirusem H5N1, u kotów rzadko stwierdza się obecność przeciwciał przeciw temu zarazkowi lub jego RNA testem RT-PCR (Marschall i wsp., 2008; Zhao FR i wsp., 2015). Jednakże w latach 2020-2023 u 11,8% (83/701) bezdomnych kotów żyjących w różnych częściach Holandii wykryto przeciwciała przeciwko antygenowi H5 tego zarazka, podczas gdy w rezerwatach przyrody, gdzie prawdopodobnie koty polowały na dzikie ptaki, aż 37,8% (31/82) kotów było serododatnich (Duijvestijn i wsp., 2024). Natomiast wśród kotów domowych, które są karmione przez opiekunów i często nie wychodzą na zewnątrz, przeciwciała przeciwko H5 wykryto u mniej niż 0,5% (4/871) kotów.
Należy podkreślić, że wirus HPAI H5N1 nadal krąży w wielu częściach świata i w latach 2021-2022 spowodował największą epidemią HPAI obserwowaną dotychczas w Europie, o ogromnym zasięgu geograficznym, obejmującym 37 krajów (Adlhoch i wsp., 2023). Co więcej, epidemia ta trwa nadal. W przeciwieństwie do sporadycznie notowanych przypadków grypy u kotów domowych, o których mowa była powyżej, w czerwcu 2023 roku lekarze weterynarii z różnych regionów Polski zgłosili kilkadziesiąt przypadków ostrej lub nadostrej, ciężkiej i wysoce śmiertelnej choroby płuc z objawami neurologicznymi u kotów. Te śmiertelne przypadki początkowo objawiały się dusznością, zajęciem płuc i objawami neurologicznymi. Później zidentyfikowano wirusa HPAI H5N1 jako czynnik etiologiczny choroby (Domańska-Blicharz i wsp., 2023). Szczegółowy przebieg tej choroby, metody diagnostyczne, w tym badanie ultrasonograficzne płuc, a także i badania laboratoryjne jednego z tych kotów zostały opublikowane (Szaluś-Jordanow i wsp., 2023). Główny lekarz weterynarii w Polsce poinformował, że do 17 lipca 2023 roku zakażenie HPAI potwierdzono u 33 kotów domowych i jednego karakala żyjącego w niewoli. Później liczba zakażonych zwierząt wzrosła, obejmując również pojedyncze przypadki u fretek i psów (Golke i wsp., 2024; Szaluś-Jordanow i wsp., 2024). Źródło tych zakażeń nie zostało w pełni poznane, w jednym przypadku najbardziej prawdopodobną przyczyną były jednak produkty drobiowe skażone wirusem H5N1 (Rabalski i wsp., 2023). Wiele z zakażonych kotów było karmionych surowym mięsem lub miało dostęp do jego resztek.
Niemal w tym samym czasie co w Polsce wirus H5N1 spowodował masową śmiertelność kotów w dwóch schroniskach w Korei Południowej (Kim i wsp., 2023). W jednym z nich 38 z 40 zakażonych kotów zmarło w ciągu miesiąca, a czas między dwoma kolejnymi zgonami wynosił maksymalnie dwa dni. Możliwą przyczyną zakażenia była karma kotów zawierająca skażone produkty kacze.
Niewiele później wirus HPAI H5N1 zaatakował bydło mleczne i koty w wielu gospodarstwach w USA (Burrough i wsp., 2024). Zakażone bydło wykazywało nieswoiste objawy, takie jak zmniejszone spożycie paszy i nagły spadek produkcji mleka, a wirus wydalany był z mlekiem w znacznych ilościach. Podejrzewano przenoszenie się wirusa pomiędzy krowami. Ponadto ponad 50% z najprawdopodobniej 24 kotów domowych przebywających w jednym gospodarstwie, które były karmione surowym (niepasteryzowanym) mlekiem i siarą od zakażonych krów, wykazywało objawy neurologiczne i padło w ciągu kilku dni od zakażenia. W Europie nie zaobserwowano dotychczas zakażeń tym zarazkiem u bydła, ale spośród 344 bezpańskich kotów przebadanych w latach 2020-2023 w różnych gospodarstwach mlecznych w Holandii 38 (11%) było serododatnich w kierunku antygenu H5 (Duijvestijn i wsp., 2024).
Podsumowując, przedstawione powyżej dane wyraźnie wskazują, że koty domowe są wrażliwe na zakażenia wirusem IAV pochodzącym od innych gatunków. Zakażenie najprawdopodobniej wynika z bliskiego kontaktu z zakażonymi ludźmi lub zwierzętami, zwłaszcza ptakami. Badania serologiczne sugerują niską do umiarkowanej częstość obecności przeciwciał u tego gatunku w odpowiedzi na występujące sezonowo szczepy ludzkie lub zwierzęce o niskiej zjadliwości oraz sporadycznie serokonwersje w kierunku wysoce zjadliwych szczepów grypy ptasiej. Wydaje się jednak, że wirusy grypy rozprzestrzeniają się powoli w populacjach kotów, co prawdopodobnie wynika z niskiej aktywności społecznej tych zwierząt, która ogranicza bezpośredni kontakt między nimi, niezbędny do efektywnego szerzenia się wirusa. Jak dotąd nie odnotowano epidemii grypy u kotów, a jedynie pojedyncze ogniska choroby w obszarach o dużym zagęszczeniu zwierząt, takich jak schroniska. Dlatego też kot domowy, jako gatunek, nie jest uważany za rezerwuar wirusa grypy. W przeciwieństwie do ludzi, koni, świń, nietoperzy, psów i niektórych innych gatunków, nie odnotowano dotychczas przypadków adaptacji IAV do kotów i coś takiego jak „wirus grypy kociej” nie jest znane.
Objawy kliniczne
Nisko zjadliwe wirusy grypy wywołują zazwyczaj jedynie zakażenie subkliniczne lub łagodną, samoograniczającą się postać choroby górnych dróg oddechowych, której objawy kliniczne u kotów obejmują kichanie oraz wypływ z nosa i/lub worków spojówkowych. Bardzo rzadko, w schroniskach lub innych skupiskach zwierząt, wtórne zakażenia bakteryjne mogą prowadzić do zapalenia płuc objawiającego się wzrostem temperatury ciała, przyspieszonym oddychaniem, dusznością, kaszlem, sennością, a nawet mogą być przyczyną śmierci (Fiorentini i wsp., 2011; Song i wsp., 2011; Jeoung i wsp., 2013; Hatta i wsp., 2018).
Chociaż możliwe jest również zakażenie bezobjawowe, wysoce zjadliwy wirus ptasiej grypy H5N1 u kotów zwykle wywołuje nasilone objawy kliniczne, takie jak wysoka gorączka występująca od pierwszego dnia po zakażeniu, senność (od drugiego dnia po zakażeniu), wypadanie trzeciej powieki, zapalenie spojówek, duszność. Może także powodować wysoką śmiertelność. W przypadku pojawienia się rozległych zmian krwotocznych u niektórych kotów obserwuje się krwisty wypływ z nosa i żółtaczkę. Można również zaobserwować drgawki, niezborność lub inne objawy neurologiczne, a także objawy żołądkowo-jelitowe (Kuiken i wsp., 2004; Thanawongnuwech i wsp., 2005; Rimmelzwaan i wsp., 2006; Songserm i wsp., 2006; Vahlenkamp i wsp., 2008).
Rozpoznawanie
U kotów wykazujących objawy ostrego zapalenia górnych dróg oddechowych należy wziąć pod uwagę grypę, jeśli wykluczono inne czynniki etiologiczne, takie jak herpeswirus i kaliciwirus kotów. Czynniki ryzyka obejmują przebywanie w schronisku i bliski kontakt z ludźmi albo zwierzętami chorymi na grypę. Dotyczy to przede wszystkim przypadków ciężkiej ostrej choroby układu oddechowego u kota wychodzącego na zewnątrz podczas epidemii wysoce zjadliwej grypy ptaków wśród drobiu i/lub dzikiego ptactwa wodnego w danym regionie (Thiry i wsp., 2007).
Zmiany patologiczne
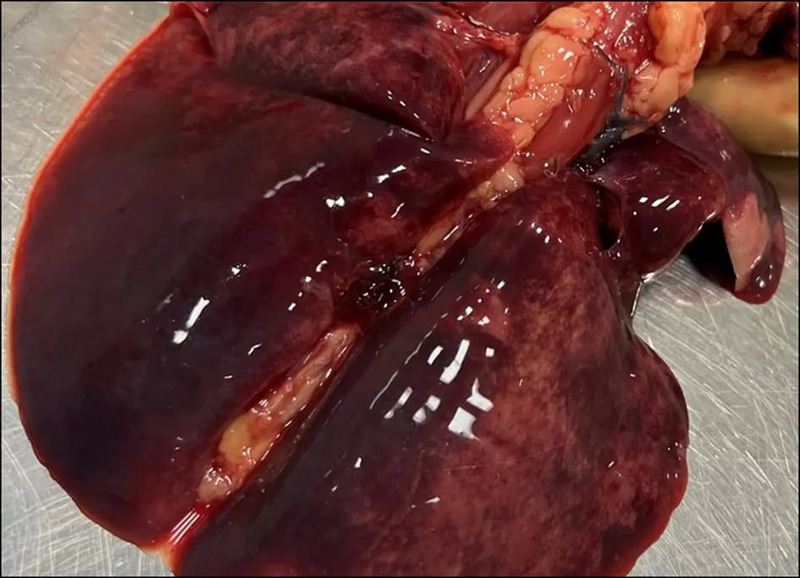
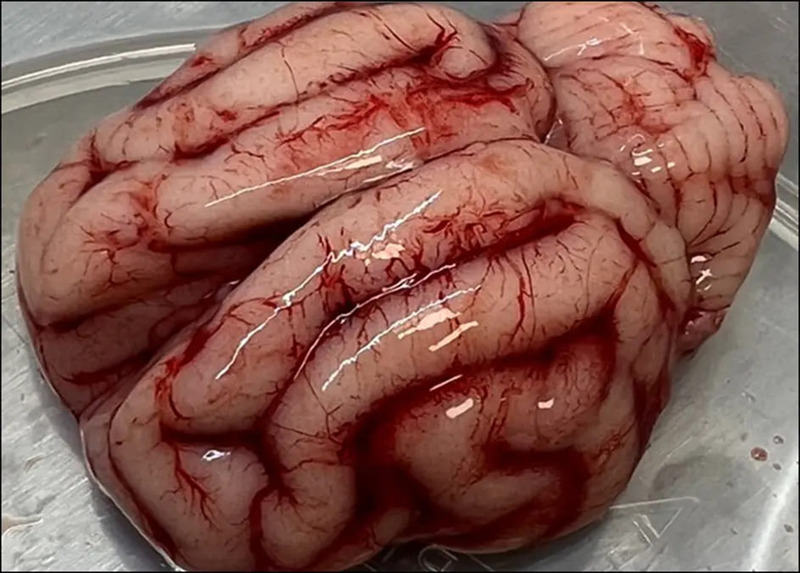
U kotów, które padły z powodu zakażenia wirusem nisko zjadliwej grypy człowieka H1N1, badania histologiczne wykazały zapalenie oskrzeli i śródmiąższowe zapalenie płuc, przerost nabłonka oskrzelików i martwicę nabłonka pęcherzyków płucnych (Fiorentini i wsp., 2011; Pigott i wsp., 2014; Knight i wsp., 2016). Podczas sekcji zwłok kotów domowych lub dzikich kotowatych zakażonych wysoce zjadliwym wirusem grypy ptasiej H5N1 stwierdzono zapalenie oskrzeli i śródmiąższowe zapalenie płuc z zastojem płucnym (ryc. 2) oraz wybroczyny i wylewy krwawe w płucach, sercu, grasicy, żołądku, jelitach, migdałkach, węzłach chłonnych żuchwowych i gardłowych oraz wątrobie, a także krwotoczne zapalenie trzustki (Keawcharoen i wsp., 2004; Yingst i wsp., 2006). Często obserwowano martwicowe zapalenie mózgu i zwojów nerwowych splotu jelitowego, a także zapalenie naczyń, zakrzepicę i ogniska martwicy w różnych narządach (Keawcharoen i wsp., 2004; Rimmelzwaan i wsp., 2006; Reperant i wsp., 2012; Sillman i wsp., 2023). Ryc. 3 przedstawia mózg kota, który zmarł z powodu zakażenia wirusem H5N1.