Niewydolność serca w aspekcie kardionefrologicznym
lek. wet. Patrycja Bednarz
Centrum Diagnostyki i Leczenia Chorób Małych Zwierząt NIEDZIELSKI we Wrocławiu
Niewydolność serca jest zespołem objawów klinicznych związanych z określonymi zmianami hemodynamicznymi, które doprowadzają do upośledzenia funkcji układu krążenia oraz zmniejszenia przepływu krwi przez narządy ważne dla organizmu. Nerki mają ścisłe połączenie czynnościowe z układem krążenia, w związku z tym są szczególnie narażone na skutki niewydolności serca. Wzajemny wpływ obu wyżej wymienionych układów oraz nierozerwalne połączenie chorób serca i nerek określa nowa, dynamicznie rozwijająca się dziedzina medycyny, w tym medycyny weterynaryjnej, zwana kardionefrologią.
Summary
Cardionephrological aspects of heart failure
Heart failure is a syndrome of clinical signs and symptoms associated with specific hemodynamic changes which lead to impaired cardiovascular function and reduced blood flow through the body’s important organs. Kidneys are closely connected functionally with the cardiovascular system, and are therefore particularly vulnerable to the effects of heart failure. The interaction of these two systems is being investigated by a new and dynamically developing branch of medicine, including veterinary medicine, called cardionephrology.
Key words: heart, kidney, cardionephrology
W upalny sierpniowy dzień do lecznicy przyniesiono psa w wieku powyżej 10 lat, który miał duszność. Właściciel zdążył poinformować lekarza, że pies ostatnio często kasłał w nocy i po wysiłku, a dzisiaj pojawiło się omdlenie i duszność.
Przeprowadzono wstępne badanie kliniczne. Błony śluzowe były blade, czas wypełnienia naczyń włosowatych (CRT – ang. capillary refill time) powyżej dwóch sekund, siny język, tętno regularne, słabo wyczuwalne, osłuchowo szmer skurczowy V/VI stopnia nad punctum maximum zastawki mitralnej, częstotliwość pracy serca 180/min, nad płucami rzężenia wilgotne, najgłośniejsze u podstawy serca.
Pacjentowi podano tlen, nitroglicerynę w maści (0,5 cm na wewnętrzną stronę małżowiny usznej), lek inotropowo dodatni (pimobendan 0,4 mg/kg m.c. w formie rozpuszczonej w glukozie, pod język) i furosemid 3 mg/kg m.c. dożylnie co 30-60 minut. Stan pacjenta został ustabilizowany. Wykonano badania uzupełniające:
- EKG ze względu na tachykardię, która ustąpiła wraz z poprawą stanu klinicznego pacjenta
- RTG klatki piersiowej w celu różnicowania choroby serca i układu oddechowego
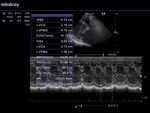
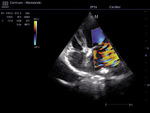
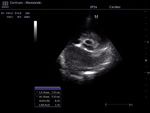
- badanie echokardiograficzne w celu wykrycia przyczyny szmeru sercowego (ryc. 1-4)
- podstawowe badania krwi (tab. I).
Kolejnym krokiem było wprowadzenie dalszej terapii. I tu pojawiło się wyzwanie, przed którym niejednokrotnie jesteśmy stawiani. Nasz pacjent z niewydolnością krążenia ma równocześnie niewydolność nerek. Co powinniśmy zrobić? Jakie leczenie zastosować?
Choroby serca bardzo często doprowadzają do upośledzonej czynności nerek. Dodatkowo zastoinowa niewydolność serca (ZNS) wiąże się z podawaniem leków, których wtórnym powikłaniem może być azotemia. Równocześnie płynoterapia stosowana w niewydolności nerek jest wielokrotnie związana z ryzykiem nadciśnienia i obciążenia pracy serca.
Wymiana poglądów między nefrologami a kardiologami doprowadziła do rozwoju dziedziny zwanej kardionefrologią. Aktualnie obowiązujące zasady leczenia chorób serca u psów i kotów opierają się na uwzględnieniu działania czynników neurohormonalnych, aktywowanych w wyniku spadku pojemności minutowej serca (CO – ang. cardiac output, inaczej rzutu serca), oraz zmniejszenia przepływu krwi przez nerki (6). Czynniki te są odpowiedzialne za rozwój choroby. Należy do nich aktywacja układu renina–angiotensyna–aldosteron (RAA) oraz układu współczulnego. Stanowią one mechanizmy kompensacyjne mające na celu poprawę rzutu serca, wzrost ciśnienia oraz zwiększenie przepływu krwi przez organizm. W początkowym etapie niewydolności serca mechanizmy te przynoszą korzyści, jednak długotrwała, przewlekła aktywacja obu wyżej wymienionych układów doprowadza do efektów niekorzystnych.
Nadmierna produkcja angiotensyny II na skutek stymulacji układu RAA jest odpowiedzialna za wzrost ciśnienia krwi, wtórny przerost lewej komory oraz włóknienie mięśnia sercowego. Dodatkowo wpływa na wytwarzanie aldosteronu, który odpowiada za wchłanianie wody i sodu w nerkach, wzrost objętości osocza oraz proces włóknienia. Ponadto angiotensyna II bierze udział w wytwarzaniu endoteliny (czynnika zwężającego naczynia krwionośne) oraz wolnych rodników, które zmniejszają biodostępność tlenku azotu (czynnika rozszerzającego naczynia). Wyżej wymienione działania skutkują wzrostem obciążenia wstępnego i następczego serca oraz w konsekwencji niewydolnością krążenia. Natomiast w nerkach utrzymujący się stan pobudzenia układu RAA doprowadza do utraty zdolności autoregulacji przez nerki oraz do ich wtórnego uszkodzenia.
Zwiększone wydzielanie noradrenaliny na skutek pobudzenia układu adrenergicznego wywołuje wzrost częstotliwości rytmu, a także przerost i włóknienie mięśnia lewej komory. Efektem jest zmniejszenie podatności komory z niewydolnością rozkurczową. Ponadto pojawia się niedokrwienie i apoptoza komórek mięśniowych, co jest odpowiedzialne za ostrą niewydolność krążenia i groźne dla życia arytmie. Pobudzenie układu współczulnego ma również wpływ na naczynia krwionośne, powodując skurcz, przerost i usztywnienie ścian naczyń. Należy tu uwzględnić naczynia nerkowe, gdyż wzrost oporu obwodowego przyczynia się do wzrostu oporu wewnątrznerkowego i niedokrwienia nerek (1, 2, 3, 4, 5, 13).
Niestety opisane powyżej układy współdziałają ze sobą, aktywując się nawzajem w „błędnym kole regulacyjnym”. W tej sytuacji nasuwają się pytania:
- jak zahamować szereg procesów neurohormonalnych, odpowiedzialnych za uszkodzenie wzajemne serca i nerek?
- które leki należałoby włączyć do terapii?
- sposób monitorowania pacjenta jako niezbędny element terapii?
W niniejszym artykule chciałabym skoncentrować się na głównych lekach kardiologicznych stosowanych w niewydolności krążenia oraz ich wpływie na czynność nerek. Wśród najczęściej używanych leków można wymienić inhibitory konwertazy angiotensyny (ACEI), diuretyki (jak furosemid, spironolakton oraz hydrochlorotiazyd), pimobendan, digoksynę oraz beta-blokery.