Dwa drobnoustroje powszechnie występujące u kotów – Toxoplasma gondii oraz koronawirus kotów (FCoV – feline coronavirus) – nie spełniają kryteriów zaproponowanych przez ACVIM i nie zostały włączone do paneli badań przesiewowych dla dawców krwi (Wardrop i wsp., 2016).
Przeciwciała przeciwko FCoV obecne w produktach krwiopochodnych mogą biernie uodporniać koty będące biorcami. W przypadku kontaktu z jakimś wirusem w ciągu kilku tygodni od transfuzji koty te mogłyby być narażone na ryzyko tzw. zależnego od przeciwciał wzmocnienia replikacji wirusa (ADE – antibody dependent enhancement) w makrofagach (Takano i wsp., 2008; Bàlint i wsp., 2014). Pomimo braku doniesień na temat rozwoju FIP wskutek transfuzji, preferuje się krew pobraną od kotów bez przeciwciał przeciwko FCoV.
Mimo że Rickettsia felis oraz inne riketsje z grupy gorączki plamistej mogą zakażać koty, nigdy nie udało się metodami molekularnymi potwierdzić ich obecności we krwi kotów. W chwili obecnej nie ma żadnych wskazań, aby badać koty oddające krew w kierunku tych drobnoustrojów (Lappin i Hawley, 2009).
Ryzyko przeniesienia czynników chorobotwórczych podczas ksenotransfuzji (przetoczenia krwi pobranej od zwierzęcia innego gatunku, zwykle od psa), jest teoretycznie zerowe w odniesieniu do FIV, FeLV i hemoplazmozy. Może być jednak znaczące w przypadku zakażeń przenoszonych przez stawonogi, spośród których niektóre występują częściej u psów niż u kotów (Otranto i Dantas-Torres, 2010). Ksenotransfuzje powinny być ograniczone do wyjątkowych sytuacji, np. stanów bezpośredniego zagrożenia życia przy braku zgodnej grupowo krwi kociej lub roztworu przenoszącego tlen***, ponieważ są one związane z opóźnionymi reakcjami hemolitycznymi na tle immunologicznym, a czas przeżycia przetoczonych krwinek czerwonych jest bardzo krótki (Bovens i Gruffydd-Jones, 2013).
Zastosowanie badań molekularnych spowodowało znaczne podwyższenie czułości i swoistości testów diagnostycznych wykrywających zarazki przenoszone drogą krwi u kotów oraz zwiększyło bezpieczeństwo przetaczania krwi i jej produktów. Zdrowe koty, u których wynik badania w kierunku obecności antygenu p27 FeLV jest ujemny, mogą mieć prowirusa FeLV wbudowanego w DNA komórek, co oznacza, że są w stanie przekazać ten zarazek wraz z krwią przetoczoną innemu kotu (Lutz i wsp., 2009; Nesina i wsp., 2015). Z tego względu banki krwi powinny badać dawców w kierunku obecności prowirusa FeLV metodą PCR. W sytuacjach bezpośredniego zagrożenia życia u dawcy można wykonać szybki test na obecność antygenu p27 FeLV, ale właściciele biorcy powinni zostać poinformowani o istniejącym ryzyku.
Badania przesiewowe wykonywane u dawców krwi są również uwarunkowane kosztami. W medycynie człowieka każdą jednostkę krwi bada się zwykle na obecność kilku najważniejszych drobnoustrojów (takich jak HIV, HBV, HCV, Treponema pallidum), natomiast z przyczyn ekonomicznych nie przeprowadza się testów w kierunku obecności innych zarazków przekazywanych drogą krwi przez zdrowych nosicieli (wirusa cytomegalii, wirusa gorączki Zachodniego Nilu, prionów, Leishmania sp. itd.). Wstępny dobór potencjalnych dawców krwi u ludzi opiera się na danych z wywiadu oraz na ryzyku związanym z przebytymi podróżami, kontaktami seksualnymi bądź konkretnymi zabiegami medycznymi. Tak samo odbywa się to w przypadku pacjentów weterynaryjnych. Najbardziej przydatny, praktyczny, szybki i niedrogi sposób na ograniczenie prawdopodobieństwa zakażenia związanego z przetoczeniem krwi polega na ocenie profilu ryzyka kotów dawców przed transfuzją na podstawie pisemnej ankiety, którą wypełnia opiekun kota oddającego krew (ryc. 2). Kwestionariusz ten może zostać przedstawiony właścicielowi razem ze zgodą na pobranie krwi od jego kota.

Idealny profil kota dawcy o niskim ryzyku to dorosły kot (w wieku powyżej trzech lat, co zmniejsza ryzyko bakteriemii wywołanej przez Bartonella sp.), niewychodzący z domu od urodzenia, żyjący od kocięcia w tym samym domu, gdzie jest jedynym kotem (właściciel powinien przedstawić pełne informacje), regularnie szczepiony i otrzymujący środki przeciwko pchłom oraz kleszczom, który nigdy nie podróżował i nie chorował na choroby przenoszone przez stawonogi. W rejonach endemicznych wskazana może być również profilaktyka w kierunku nicieni sercowych, chociaż krew pobrana od zarażonych kotów nie powoduje inwazji po przetoczeniu (Lee i Atkins, 2010).
Przed każdym przetoczeniem krwi należy ocenić związane z nim ryzyko. Może to wyeliminować konieczność powtarzania drogich i czasochłonnych badań w kierunku obecności drobnoustrojów przenoszonych z krwią u kotów, u których związane z tym ryzyko jest niskie. Częstotliwość wykonywania badań zależy od czynnika chorobotwórczego (występujący sezonowo lub nie) oraz indywidualnego narażenia na zakażenie. Rada ABCD nie zaleca wykorzystywania jako dawców krwi kotów żyjących w zamkniętych skupiskach, hodowanych specjalnie dla banków krwi, ponieważ ze względu na dobrostan zwierząt powinny one żyć w bardziej naturalnym otoczeniu.
Jeżeli krew z banku krwi nie jest dostępna, lekarze weterynarii powinni mieć zapewnioną odpowiednią liczbę wyselekcjonowanych potencjalnych dawców, ocenionych jako koty niskiego ryzyka, o ujemnych wynikach badań w kierunku najważniejszych czynników chorobotwórczych przenoszonych drogą krwi. Jako dawców krwi można ewentualnie brać pod uwagę koty ze schroniska, w zależności od tego, na ile znana jest ich historia oraz pod jak dobrą opieką się znajdują. Badanie kliniczne przeprowadzone po uzyskaniu danych z wywiadu powinno uwzględniać dokładną ocenę okrywy włosowej i wyczesanie pacjenta grzebieniem w celu wykluczenia obecności pcheł i kleszczy. Kotów, u których stwierdza się występowanie pcheł bądź kleszczy, nie powinno się brać pod uwagę jako dawców krwi (Wardrop i wsp., 2005).
Wykorzystanie przypadkowego dawcy w nagłej sytuacji zagrożenia życia zawsze zwiększa ryzyko związane z przetoczeniem krwi. Konieczność znalezienia dawcy mającego krew zgodną grupowo z krwią biorcy może bowiem łatwo doprowadzić do zaniedbania ważnych kryteriów dotyczących jego stanu zdrowia. Co więcej, w stanach nagłych do badania dawcy można wykorzystać jedynie testy możliwe do wykonania w zakładzie leczniczym (in-house tests). Oznacza to, że po przeprowadzeniu badania klinicznego, badania morfologicznego krwi, biochemicznego surowicy i ogólnego moczu wykonuje się tylko badania w kierunku zakażenia retrowirusami. Na wypadek gdyby konieczna była dalsza diagnostyka, powinno się zachować dane biorcy i dawcy oraz próbkę krwi dawcy pobraną na EDTA. W tym celu można wykorzystać próbkę pobraną do badania morfologicznego krwi. Należy ją przechowywać zamrożoną w temperaturze -20°C.
Inne zastosowania produktów krwiopochodnych w praktyce
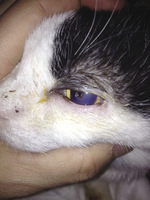
Surowica wkroplona do worka spojówkowego używana jest w leczeniu antykolagenolitycznym głębokich wrzodów rogówki (Hartley, 2010; Mitchell, 2013) (ryc. 3), choć brak dowodów naukowych na skuteczność takiego postępowania. Preparat składający się z autologicznej surowicy jest tani i prosty w podaniu, musi jednak zostać przygotowany w ściśle aseptycznych warunkach, opisanych powyżej w kontekście pobierania krwi. Aby nie doszło do zakażenia bakteryjnego, należy stosować jałowe materiały (probówka, pipeta, buteleczka do kropli do oczu z kroplomierzem). Preparat powinien być przechowywany w temperaturze 4°C i zużyty najszybciej, jak to możliwe (optymalnie w ciągu 48 godzin), ponieważ duża częstotliwość podawania preparatu (nawet raz na godzinę) zwiększa ryzyko przedostania się do niego bakterii. W przypadku bardzo młodych kociąt lub innych trudności z pobraniem krwi od pacjenta można wykorzystać surowicę homologiczną (od innego kota), a nawet surowicę psa. Ta ostatnia zmniejsza ryzyko przeniesienia zarazków kocich do błony śluzowej oka i uszkodzonej tkanki rogówki (Mitchell, 2013). W przypadku surowicy homologicznej, jej dawca powinien zostać starannie dobrany, zgodnie z tymi samymi kryteriami, które stosuje się w przypadku dawców krwi. Niemniej jednak, z uwagi na to, że obecnie nie są dostępne żadne badania kontrolne, które potwierdzałyby skuteczność i nieszkodliwość tego rodzaju postępowania u kotów, nie można zalecić jego stosowania.
NAJWAŻNIEJSZE KWESTIE
- Należy unikać przetaczania krwi pacjentom w terminalnej fazie choroby.
- Każdy etap przetaczania krwi powinien być wykonywany z zachowaniem bezwzględnych zasad higieny, nawet w przypadku bezpośredniego zagrożenia życia pacjenta.
- Im więcej czasu upływa od momentu pobrania krwi do jej przetoczenia, tym większe jest ryzyko jej skażenia.
- Opakowania do przechowywania krwi powinny być dokładnie obejrzane przed ich użyciem i zniszczone, jeżeli doszło do zmiany ich koloru lub wykrycia innej nieprawidłowości.
- Uznawany na świecie panel badań przesiewowych dla kotów dawców obejmuje badania w kierunku zakażeń FeLV, FIV i Bartonella sp. oraz hemoplazmozy kotów.
- Pomimo braku doniesień na temat rozwoju FIP u kotów poddanych transfuzji, preferuje się krew pobraną od kotów bez przeciwciał przeciwko FCoV.
- Najbardziej przydatny, praktyczny, szybki i niedrogi sposób ograniczenia prawdopodobieństwa zakażenia związanego z przetoczeniem krwi polega na ocenie profilu ryzyka kotów dawców na podstawie pisemnej ankiety dla opiekuna.
- Ocena ryzyka może wyeliminować konieczność powtarzania drogich i czasochłonnych badań w kierunku obecności zarazków przenoszonych drogą krwi u kotów, u których profil ryzyka jest niski.
- Nigdy nie należy brać pod uwagę zdziczałych kotów bezdomnych jako potencjalnych dawców krwi.
Autologiczne osocze bogatopłytkowe znajduje coraz szersze zastosowanie w leczeniu zaburzeń ortopedycznych w praktyce weterynaryjnej, w tym również u kotów. Podczas jego przygotowywania również może dojść do zakażenia bakteryjnego. Aby ograniczyć związane z tym ryzyko, należy ściśle przestrzegać zasad higieny (Hoareau i wsp., 2014).