Problem – zanieczyszczenie materiału cytologicznego krwią
Część lekarzy praktyków podczas pobierania materiału cytologicznego wybiera metodę biopsji cienkoigłowej z aspiracją (np. igła 22 G przyłączona do strzykawki o pojemności 5 ml). W przypadku tej metody, igłę wraz z podłączoną strzykawką należy wprowadzić w masę guza lub tkanki i jednokrotnie szybko cofnąć tłoczek, aby wytworzyć ujemne ciśnienie w cylindrze strzykawki. Nadmierne wysunięcie tłoczka nie spowoduje pobrania większej ilości materiału, ale zwiększy prawdopodobieństwo uszkodzenia komórek oraz zanieczyszczenia pobieranego materiału krwią. Kiedy igła jest częściowo wycofywana ze zmiany i ponownie ostrożnie w nią wprowadzana, ale pod innym kątem, w celu aspiracji materiału z innych jej obszarów, wytworzone w strzykawce ujemne ciśnienie utrzymuje się. Zmiana kierunku wkłucia igły powinna odbywać się ostrożnie, aby uniknąć rozległego uszkodzenia tkanek i krwawienia. Następnie, przed całkowitym wysunięciem igły z tkanki, należy puścić tłoczek strzykawki, delikatnie znosząc ujemne ciśnienie, aby uniknąć zaaspirowania komórek z kanału igły do cylindra strzykawki, co grozi ich nieodwracalną utratą. Po wyjęciu igły z nakłuwanej zmiany odłącza się ją od strzykawki. Cofając tłoczek strzykawki, nabiera się do niej powietrza, a następnie ponownie podłącza się strzykawkę do igły zawierającej zaaspirowany materiał. Dociskając tłoczek strzykawki, przenosimy badany materiał z kanału igły na szkiełko mikroskopowe. Następnie z pobranego materiału wykonuje się rozmaz cytologiczny, stosując techniki opisane poniżej.
Doskonałą alternatywę dla pobierania materiału cytologicznego metodą biopsji aspiracyjnej cienkoigłowej, która jest opisana powyżej, stanowi zastosowanie techniki biopsji cienkoigłowej bez aspiracji (ang. sewing machine lub woodpecker technique), gdzie wykorzystuje się samą igłę, bez wytworzenia ujemnego ciśnienia za pomocą strzykawki. Igłę wprowadza się do zmiany, a następnie pobiera materiał, kilkakrotnie zmieniając ułożenie igły w zmianie poprzez jej delikatne wycofywanie i wprowadzanie pod innym kątem. Igłę można częściowo lub całkowicie wyjąć i wprowadzić ponownie w innym miejscu nakłuwanej zmiany. Następnie igłę podłącza się do wypełnionej powietrzem strzykawki i przenosi się pobrany materiał na szkiełko mikroskopowe w celu wykonania rozmazu cytologicznego.
Należy pamiętać, że niektórym zmianom, takim jak naczyniaki krwionośne, naczyniaki krwionośne mięsakowe, guzy tarczycy lub guzy z komórek tucznych, często towarzyszy znaczne zanieczyszczenie pobranego materiału krwią, z uwagi na ich silne unaczynienie.
Problem – uszkodzone komórki w preparatach cytologicznych
Niektóre godne polecenia podręczniki weterynaryjne szczegółowo omawiają pobieranie materiału i przygotowywanie preparatów cytologicznych (patrz lista polecanych pozycji na końcu artykułu). Ponadto, dzięki postępowaniu zgodnie z punktami podanymi poniżej, można uniknąć uszkodzenia komórek, a przez to zwiększyć prawdopodobieństwo uzyskania preparatów wysokiej jakości.
1. Należy unikać igieł o małej średnicy (< 25 G), ponieważ ich zastosowanie może doprowadzić do uszkodzenia komórek w czasie aspiracji lub przenoszenia materiału z kanału igły na szkiełko mikroskopowe (uwaga: niektórzy patolodzy odradzają stosowania igieł 25 G, podczas gdy inni uważają, że mogą być one używane do pozyskiwania diagnostycznych próbek).
Kiedy materiał zostanie już przeniesiony z kanału igły na szkiełko podstawowe, należy natychmiast wykonać z niego rozmaz cytologiczny. Jest to ważne, ponieważ w ten sposób unika się powstania w rozmazie skupisk komórek lub wykonania grubych preparatów, co sprawia, że pobrany materiał nie nadaje się do oceny (ryc. 2). Popularna technika wykonywania rozmazów cytologicznych (ang. squash prep lub slide-over-slide technique) (patrz tekst w ramce na str. 30) polega na przeniesieniu zaaspirowanego materiału na czyste fabrycznie szkiełko podstawowe, blisko jednego z jego końców, najlepiej tego ze szlifem. Następnie na kropli aspiratu delikatnie umieszcza się płasko drugie szkiełko podstawowe, pod kątem prostym w stosunku do pierwszego szkiełka. Oba szkiełka widziane od góry tworzą krzyż. Płynnym ruchem wykonywanym w płaszczyźnie poziomej rozprowadza się pobrany materiał na całej długości szkiełka mikroskopowego. Należy podkreślić, że ciężar własny górnego, rozprowadzającego szkiełka jest wystarczający do rozprowadzenia materiału i jakikolwiek dodatkowy nacisk wywierany palcami na szkiełko zwiększa jedynie prawdopodobieństwo uszkodzenia komórek.
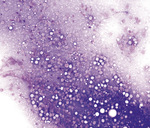
Preparaty cytologiczne można również wykonywać, stosując taką samą technikę jak w przypadku wykonywania rozmazów krwi. Technika ta jest często użyteczna w przypadku wykonywania rozmazów cytologicznych ze zmian chełboczących lub torbieli oraz płynów z jam ciała.
Inny sposób wykonania preparatu cytologicznego (ang. starfish technique) polega na delikatnym rozprowadzeniu materiału po szkiełku podstawowym za pomocą igły, którą prowadzi się od środka kropli aspiratu na zewnątrz, tak aby powstały liczne cienkie pasma materiału przypominające wyglądem rozgwiazdę. Technika ta może okazać się szczególnie korzystna w przypadku stale powtarzającego się uszkodzenia komórek w trakcie wykonywania rozmazu cytologicznego metodą tradycyjną.
Jeżeli wykonuje się preparaty odciskowe (np. w przypadku pobranego operacyjnie fragmentu tkanki), korzystnym postępowaniem przed wykonaniem preparatu jest usunięcie nadmiaru krwi z tej powierzchni tkanki, z której będzie wykonywany odcisk, przez jej lekkie przyłożenie do gazy lub bibuły. Po osuszeniu powierzchni tkanki dotyka się nią kilkakrotnie do powierzchni szkiełka podstawowego, tworząc szereg odcisków. Aby zminimalizować ryzyko uszkodzenia komórek, należy unikać przykładania znacznej siły podczas odciskania tkanki lub przesuwania jej po szkiełku.
2. Nie wolno przetrzymywać niezabarwionych preparatów cytologicznych w lodówce lub zamrażarce, trzeba też pamiętać o tym, aby zawsze umożliwić preparatom wyschnięcie na powietrzu, zanim umieści się je w pojemnikach lub w inny sposób opakuje się je do transportu. Aby przyspieszyć proces suszenia preparatów cytologicznych, można posłużyć się suszarką do włosów, ale trzeba kontrolować proces suszenia, aby uniknąć zbyt długiego nagrzewania preparatów. Jeżeli niezabarwione preparaty cytologiczne zostaną włożone do lodówki lub opakowane do transportu jeszcze przed ich całkowitym wysuszeniem, może dojść do znacznego stopnia zniekształcenia komórek.

3. Nie wolno dopuszczać do kontaktu materiału przeznaczonego do badań cytologicznych z formaliną lub jej parami. W wyniku takiego kontaktu również powstają znaczne artefakty, które sprawiają, że pobrany materiał cytologiczny staje się niediagnostyczny (ryc. 3). Do kontaktu z formaliną może dojść, gdy niezabarwione preparaty cytologiczne i próbki tkanek są przewożone w jednym opakowaniu.
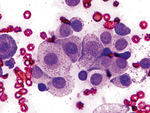
4. Należy zachować szczególną ostrożność podczas wykonywania rozmazów cytologicznych z aspiratów pobranych z węzłów chłonnych, ponieważ w tych preparatach najczęściej dochodzi do uszkodzenia komórek, z uwagi na ich delikatność. W uzyskaniu materiału cytologicznego z węzłów chłonnych o wysokiej jakości diagnostycznej zwykle pomaga wykonywanie biopsji cienkoigłowej metodą bez aspiracji (ryc. 4). W przypadku uogólnionego powiększenia węzłów chłonnych, aspiraty należy pobrać z kilku z nich, aby zwiększyć prawdopodobieństwo uzyskania materiału o wysokiej jakości diagnostycznej. Następnie każde szkiełko mikroskopowe należy właściwie oznaczyć, aby wiadomo było, z którego węzła chłonnego pochodzi dany materiał. Niektóre z laboratoriów traktują materiał pobrany z wielu węzłów chłonnych jako jedną próbkę i zgodnie z tym pobierają opłatę za wykonanie jednego badania. Lekarz prowadzący powinien przed przekazaniem materiału do badań sprawdzić zasady działania danego laboratorium histopatologicznego, aby uniknąć nieoczekiwanych kosztów za wykonanie większej liczby badań, niż się spodziewał.
Problem – niejednoznaczny obraz histopatologiczny lub niezadowalający wynik badania
Do badania histopatologicznego należy pobrać tak dużą próbkę, jak jest to tylko możliwe (oczywiście w granicach rozsądku), aby zwiększyć prawdopodobieństwo uzyskania reprezentatywnych wycinków. Jeżeli jest to konieczne, należy pobrać kilka wycinków, szczególnie jeżeli wydaje się, że tkanka przeznaczona do badania zawiera duże obszary wylewów krwi lub martwicy.
Ważne jest również zastosowanie wystarczającej – w stosunku do wielkości próbki i objętości pojemnika – ilości formaliny. Minimalny stosunek 10% zbuforowanej formaliny do objętości tkanki, który należy zachować, wynosi 10 : 1, chociaż niektórzy patolodzy zalecają stosunek 20 : 1. Wraz ze wzrostem grubości tkanki szybkość penetracji formaliny do tkanki i proces jej utrwalenia zmniejsza się istotnie, a nieutrwalona tkanka ulega autolizie, co utrudnia lub uniemożliwia interpretację obecnych w niej zmian histopatologicznych. Dlatego też lekarze praktycy powinni być tego świadomi i jeżeli tylko jest to możliwe, powinni stosować się do wytycznych dotyczących grubości przesyłanych wycinków. Jest to szczególnie istotne w przypadku tkanek silnie unaczynionych, w których często występuje zastój krwi, takich jak śledziona, wątroba i nerki.














