Idealna grubość wycinka z punktu widzenia optymalnego utrwalenia tkanek wynosi 0,5 do 1 cm. Takie wycinki powinno się pobierać jako reprezentatywne ze zmian, których nie udało się usunąć w całości lub których resekcja jest niewykonalna. W przypadku pobierania większych fragmentów tkanek, niezbędne może się okazać ich nacięcie, aby umożliwić penetrację całej tkanki przez formalinę (np. splenektomia z powodu obecności guza). W przypadku bardzo małych wycinków, zaleca się włożenie ich do kasetki histopatologicznej, służącej do zatapiania materiału, w której dodatkowo umieszcza się kawałki gąbki, gdy wycinki są mniejsze niż wielkość oczek w jej ściankach.
W przypadku usuniętych guzów, kiedy konieczna jest ocena czystości onkologicznej marginesu chirurgicznego (np. guzy z komórek tucznych, mięsaki tkanek miękkich), materiał należy wysłać w całości. Należy także właściwie oznaczyć marginesy tkankowe (np. tuszem, nicią chirurgiczną) oraz dołączyć objaśnienie przeznaczone dla technika lub patologa dotyczące usytuowania przesyłanego guza. Na przykład można napisać: „Dwa szwy są założone na doczaszkowym, a jeden na doogonowym krańcu guza”. Z wyjątkiem oznaczenia za pomocą tuszu lub nici chirurgicznych, brzegi guza nie powinny być nacięte ani rozcięte.
Wycinki tkanek pobrane metodą endoskopową powinny być liczne (8 do 10 z jednego miejsca), aby umożliwić jak najlepszą ocenę całej grubości błony śluzowej i podśluzowej. Próbki pobrane jedynie z błony śluzowej mają mniejszą wartość diagnostyczną.
Podczas pobierania i dalszego postępowania z materiałem należy zachować daleko idącą ostrożność, aby uniknąć uszkodzenia (zgniecenia) tkanek. Często spotyka się to w przypadku wycinków skóry. Granica między zmianą patologiczną a tkanką prawidłową jest zawsze ważna dla patologa, a w przypadku wycinków skóry jej obraz jest szczególnie istotny. Należy tak pobierać wycinek skóry, żeby zawierał on miejsce przejścia zmiany w zdrową tkankę. Jeżeli zmiany skórne są duże lub wieloogniskowe, zaleca się pobranie wielu wycinków, aby zwiększyć szansę na uzyskanie reprezentatywnych próbek. Należy unikać pobierania wycinków jedynie z miejsc owrzodzonych, ponieważ dla ustalenia rozpoznania zwykle decydujące znaczenie ma ocena nieuszkodzonego naskórka. Powinno się unikać usuwania powierzchownych strupów w sposób urazowy. Jakiekolwiek fragmenty materiału ukruszone podczas pobierania muszą być do niego dołączone.
Wycinki tkanek powinny być przekazywane w słoikach lub pojemnikach oznakowanych nazwiskiem klienta i pochodzeniem pobranych wycinków. Kiedy pobranych jest wiele wycinków pochodzących z różnych miejsc, każdy pojemnik powinien być oznaczony indywidualnie nazwiskiem klienta i miejscem pobrania materiału. Tkanki, które są przekazywane do badania histopatologicznego, nigdy nie powinny być zamrożone, chyba że na wyraźną prośbę laboratorium lub patologa w celu wykonania specjalnych technik histopatologicznych. Tak jak w każdym przypadku, należy również dołączyć pismo przewodnie, zawierające historię choroby danego pacjenta, a także wszystkie istotne informacje oraz wyniki wykonanych badań.
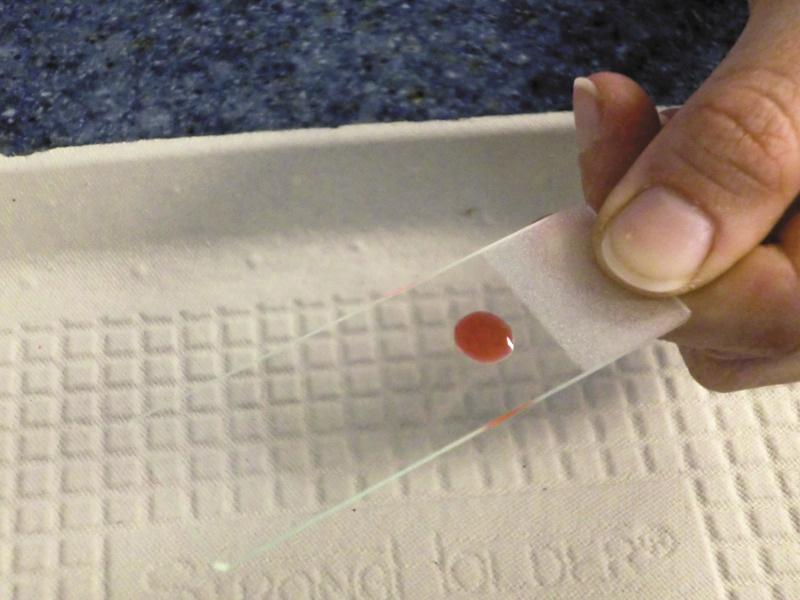
Technika wykonywania rozmazów cytologicznych (ang. squash prep lub slide-over-slide technique)
Podsumowanie
Właściwe przekazywanie materiału do badań histopatologicznych i lepsze porozumienie pomiędzy lekarzem praktykiem i patologiem zwiększy prawdopodobieństwo uzyskania prawidłowego wyniku badania histopatologicznego. Poprawi to jakość opieki nad pacjentem oraz zadowolenie klientów i zmniejszy szansę wystąpienia powikłań.
Podziękowania
Autorzy pragną podziękować za wsparcie następującym osobom:
- • MedVet Medical and Cancer Center for Pets, Worthington, Ohio: Lisa Fulton, DVM, DACVIM (onkologia), oraz Eric R. Schertel, DVM, PhD, DACVS
- • Charles River Laboratories, Department of Pathology, Reno, Nevada: David V. Calise, DVM, MS, DACVP (anatomia patologiczna), oraz Angela Wilcox, BVSc, MS, DACVP (patologia kliniczna)
- • Texas A&M College of Veterinary Medicine, Department of Pathobiology, College Station, Texas: Mark C. Johnson, DVM, DACVP (patologia kliniczna)
- • IDEXX Laboratories, Inc.: Stephanie Corn, DVM, DACVP (patologia kliniczna), Worthington, Ohio, Dean Cornwell, DVM, PhD, MT, Dallas, Texas, oraz Rick L. Cowell, DVM, MS, MRCVS, DACVP (patologia kliniczna), Stillwater, Okla.
Veterinary Medicine • Vol 106, No 3, March 2011, p. 132
Seth Chapman, DVM, MS, DACVP (patologia kliniczna)
IDEXX Laboratories, 300 E. Wilson Bridge Road, Worthington, OH 43085
Jason Roberts, DVM
West Tennessee Animal Diseases Diagnostics Laboratory, The University of Tennessee, Martin, TN 38238