Mimo że zakażenie dermatofitami dotyczy wyłącznie powierzchownych struktur zrogowaciałych, indukuje ono zarówno odpowiedź komórkową, jak i humoralną. Znacząca aktywacja populacji limfocytów Th2 wraz z charakterystycznym dla niej profilem cytokin prowadzi do wytwarzania przeciwciał i rozwinięcia się przewlekłego stanu chorobowego. Natomiast aktywacja limfocytów Th1 stymuluje mechanizmy odpowiedzi komórkowej charakteryzujące się obecnością interferonu gamma oraz interleukin Il-12 i Il-2, prowadzące do wyzdrowienia (Sparkes i wsp., 1995; Moriello i DeBoer, 2012). Zwierzęta, u których doszło do uruchomienia tych mechanizmów, chronione są przed powtórnym zakażeniem (Sparkes i wsp., 1993a). Rola odpowiedzi humoralnej w zakażeniach grzybiczych pozostaje niejasna, pojawiające się przeciwciała mogą jednak wykazywać efekt fungistatyczny poprzez mechanizm opsonizacji i aktywacji układu dopełniacza (Sparkes i wsp., 1994a).
Objawy kliniczne
U wielu kotów dermatofitoza przebiega w łagodnej, samoograniczającej się postaci, przejawiającej się utratą włosów i łuszczeniem się naskórka (ryc. 1).
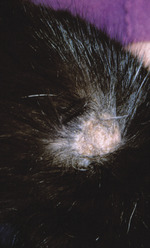
Typowymi zmianami skórnymi w przebiegu dermatofitozy kotów są regularne, okrągłe obszary wyłysień, łamliwość włosów, łuszczenie się naskórka, a niekiedy również obecność zmian pierścieniowych z obwodowym rumieniem otaczającym wewnętrzny obszar gojenia się (Chermette i wsp., 2008; Moriello i DeBoer, 2012). Zmiany są czasem bardzo małe, a czasem osiągają średnicę 4-6 cm. Wykwity mogą występować pojedynczo lub w formie mnogiej. Na ogół lokalizują się na głowie, choć mogą obejmować każdy obszar ciała (ryc. 2), w tym obwodowe odcinki kończyn i ogon. U młodych kotów pierwsze zmiany często pojawiają się na grzbiecie nosa, a następnie stopniowo rozszerzają się, obejmując okolice skroniowe oraz zewnętrzne powierzchnie i krawędzie małżowin usznych (ryc. 3). Zmiany mnogie mogą zlewać się ze sobą. Świąd towarzyszący dermatofitozie może mieć różne nasilenie, lecz zazwyczaj jest nieznaczny lub umiarkowany. W większości przypadków chorobie nie towarzyszy gorączka ani brak apetytu (Chermette i wsp., 2008; Moriello i DeBoer, 2012). Niekiedy dermatofitoza kotów może przebiegać w postaci grudek i strupów („prosówkowe zapalenie skóry”) lokalizujących się głównie na grzbiecie.
U osobników z immunosupresją przewlekła dermatofitoza może objawiać się jako rozległe zmiany skórne powikłane zakażeniami bakteryjnymi. U takich pacjentów obserwuje się nietypowe, duże obszary wyłysień i rumienia, świąd, wysięk i strupy. W tej fazie dermatofitoza może przypominać wiele różnych chorób skóry. Wykwity typowe dla grzybicy można czasami dostrzec na obwodzie powyższych zmian.
W rzadkich przypadkach dermatofitoza może objawiać się zniekształceniem pazurów lub zanokcicą, a jeszcze rzadziej może przebiegać jako guzkowe ziarniniakowe zapalenie skóry (pseudomycetoma), z obecnością pojedynczych lub mnogich, twardych, niebolesnych guzków (Nuttall i wsp., 2008). Guzki te mogą otwierać się na powierzchni skóry w postaci sączących przetok. Pseudomycetoma (jako guzowata zmiana na brzuchu) u zwierzęcia ze skórną postacią dermatofitozy może stanowić rzadkie powikłanie zabiegu laparotomii (Black i wsp., 2001).
Rozpoznanie
Ponieważ obraz kliniczny dermatofitozy u kotów może przypominać objawy wielu innych chorób skóry, należy zawsze brać ją pod uwagę w diagnostyce różnicowej wszelkich zmian skórnych pojawiających się u tego gatunku. Przed rozpoczęciem jakiegokolwiek leczenia powinno się zatem w pierwszym rzędzie wykluczyć dermatofitozę.

Mało kosztownym i łatwym do wykonania w warunkach klinicznych badaniem przesiewowym w przypadku podejrzenia zakażenia M. canis jest badanie lampą Wooda. Zakażone włosy powinny wykazywać jasnozieloną fluorescencję. Powszechnie twierdzi się, że metoda ta odznacza się małą czułością, ponieważ fluorescencję wykazuje tylko 50% szczepów M. canis, a pozostałe gatunki dermatofitów w ogóle nie mają tej właściwości (Sparkes i wsp., 1994c). Ponadto kruszywo komórkowe, łupież, strzępki waty i niektóre leki, np. tetracyklina, mogą być powodem wyników fałszywie dodatnich. Zatem wynik badania lampą Wooda należy zawsze potwierdzić innymi technikami diagnostycznymi. Jednakże, jak pokazały ostatnie badania (Moriello, 2014), przynajmniej część tzw. „niefluoryzujących” szczepów dermatofitów można wyizolować od kotów, które de facto nie są zakażone, a jedynie biernie przenoszą zarodniki grzybów na swoich włosach (zarodniki nie wykazują fluorescencji). Ponadto według doświadczeń wspomnianej autorki liczbę wyników fałszywie dodatnich i fałszywie ujemnych w znacznym stopniu może ograniczyć właściwa technika badania. Wreszcie przypuszcza ona, że rozbieżności odnośnie do przydatności lampy Wooda mogą częściowo wynikać z różnej jakości dostępnych jej modeli i konkluduje, że lampa z wbudowanym szkłem powiększającym w centralnym obszarze widzenia w rękach doświadczonego obserwatora jest bardzo skuteczną wstępną metodą diagnostyczną dermatofitozy (medycyna oparta na dowodach – IV kategoria badań). Wiele praktycznych wskazówek co do właściwego użycia lampy Wooda zawiera wspomniana publikacja (Moriello, 2014).
Kolejną szybką i prostą metodą diagnostyczną pozwalającą na stwierdzenie obecności dermatofitów we włosach lub złuszczonym naskórku jest bezpośrednia ocena mikroskopowa materiału. Zdecydowanie zaleca się, żeby materiał badawczy w postaci wyrwanych włosów pobierać do analizy w świetle lampy Wooda, ponieważ jest to znacznie skuteczniejsze niż pozyskiwanie materiału tylko z obrzeży zmian skórnych (Moriello, 2014). Próbkę przed jej oceną należy umieścić w 10-20% roztworze KOH, choć możliwa jest też analiza w kropli oleju parafinowego (Moriello, 2014). Istnieje kilka sposobów poprawiających widoczność elementów grzyba we włosach (Moriello i DeBoer, 2012). Włosy lub fragmenty włosów ze strzępkami albo artrosporami są grubsze i mają nieregularną, szorstką powierzchnię. Jednak bezpośrednie badanie mikroskopowe może również dać wynik fałszywie dodatni, ze względu na obecność zarodników grzybów saprofitycznych lub zanieczyszczeń próbki, mylnie rozpoznawanych jako elementy dermatofitów. Ponadto czułość tej metody jest stosunkowo mała i określa się ją na 56% (Sparkes i wsp., 1993b). Wyższą czułością (76%) odznacza się mikroskopowe badanie z użyciem barwnika fluorescencyjnego Calcofluor White, silnie wiążącego się ze strukturami zawierającymi celulozę i chitynę (Sparkes i wsp., 1994c).
Złotym standardem w przypadku diagnostyki dermatofitozy u kotów pozostaje hodowlane badanie mikologiczne na podłożach różnicujących, takich jak pożywka Sabourauda z dekstrozą lub inne. Metoda ta odznacza się wysoką czułością i dzięki jej zastosowaniu możliwa jest identyfikacja gatunku dermatofita. Próbki (włosy, złuszczony naskórek) należy pobrać z krawędzi świeżo powstałych zmian, po delikatnym przetarciu powierzchni skóry alkoholem w celu ograniczenia zanieczyszczenia bakteryjnego. Jeśli podejrzewa się zakażenie subkliniczne lub bierne nosicielstwo, powinno się wyczesywać włosy zwierzęcia przez pięć minut jałową szczoteczką, gdyż jest to najskuteczniejszy sposób zebrania wartościowego diagnostycznie materiału. Fabrycznie zapakowane szczoteczki do zębów są sprzedawane jako produkt mikologicznie sterylny (Moriello i DeBoer, 2012). Po pobraniu materiału powyższą techniką liczba kolonii wzrastających na podłożu koresponduje z nasileniem zakażenia. Na tej podstawie niektóre schroniska wprowadziły tzw. „wskaźnik liczby drobnoustrojów” jako metodę monitorowania skuteczności leczenia (Moriello, 2014). Obecnie dostępnych jest handlowo kilka podłoży wybiórczych do zastosowania w warunkach lecznicowych [np. dermatophyte test media (DTM) – podłoża do wykrywania dermatofitów], w których przypadku o wzroście dermatofitów świadczy zmiana barwy pożywki. Jak dotąd jednak przeprowadzono niewiele badań oceniających rzeczywistą przydatność tego typu podłoży u pacjentów weterynaryjnych (Chermette i wsp., 2008). Dlatego też każdą podejrzaną kolonię należy dodatkowo zweryfikować mikroskopowo w celu potwierdzenia obecności dermatofitów (Moriello i DeBoer, 2012).
Do wykrywania w próbce M. canis proponuje się również zastosowanie techniki PCR (Nardoni i wsp., 2007).
Leczenie
W przypadku kotów, u których układ immunologiczny funkcjonuje prawidłowo, zmiany wycofują się samoistnie po 1-3 miesiącach i leczenie może okazać się zbędne. Mimo wszystko jednak zastosowanie leczenia w takich przypadkach łagodzi objawy choroby, zmniejsza ryzyko zakażenia innych zwierząt i człowieka oraz ogranicza skażenie środowiska.
W terapii koniecznym elementem jest leczenie miejscowe, ponieważ stanowi ono jedyną możliwość likwidacji zarodników na włosach zwierzęcia (Moriello, 2014). Preparaty o działaniu miejscowym u kotów nie są jednak tak skuteczne jak u ludzi ze względu na słabe przenikanie substancji czynnych przez okrywę włosową zwierzęcia, złe znoszenie przez większość kocich pacjentów aplikacji tego rodzaju leków oraz możliwość przeoczenia mniejszych zmian. Postępowanie lecznicze powinno zatem obejmować połączenie terapii ogólnej i miejscowej. Musi ono trwać co najmniej 10 tygodni. Leczenie prowadzi się nie tylko do momentu wycofania się zmian skórnych, lecz do chwili otrzymania w odstępie 1-3 tygodni dwóch ujemnych wyników posiewu materiału pobranego z włosów zwierzęcia techniką wyczesywania.
W hodowlach i schroniskach dermatofitozę bardzo trudno zlikwidować. Jest to proces zarówno czasochłonny, jak i kosztowny. Dlatego też niezbędne jest skrupulatne przestrzeganie przez właścicieli zwierząt wszystkich zaleceń lekarskich. Należy wyznaczyć plan działań terapeutycznych, całkowicie oddzielić zwierzęta zakażone od niezakażonych oraz prowadzić intensywne czyszczenie i odkażanie środowiska. Wskazane jest podzielenie kotów na trzy kategorie:














