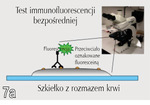
Wykrywanie wewnątrzkomórkowych białek gag (w tym p27) testem immunofluorescencji (IFA – immunofluorescence assay)
Pierwszą metodą pozwalającą na wykrycie wirusa FeLV u kotów z trwałą wiremią w warunkach klinicznych była immunofluorescencja pośrednia (ryc. 7), którą wprowadzono w roku 1973 (Hardy i wsp., 1973). Opierała się ona na obserwacji, że granulocyty, limfocyty i płytki krwi u takich kotów zawierają elementy gag, które można wykryć za pomocą IFA w rozmazie krwi. Metoda IFA daje więc wynik dodatni później niż test ELISA i jedynie w fazie wtórnej (trwałej) wiremii, kiedy to wirus zakaził już szpik kostny. Czułość IFA jest znacząco mniejsza niż testu ELISA (Hawks i wsp., 1991, I stopień EBM). Jeżeli u kota z trwałym zakażeniem występuje leukopenia bądź jeżeli wirus zakaził jedynie niewielki odsetek krążących leukocytów we krwi obwodowej, wówczas test IFA może nie wykryć FeLV. Co więcej, wszystkie eozynofile wykazują tendencję do wiązania fluoresceiny , którą stosuje się jako wskaźnik w IFA. A zatem, jeżeli nie oceni się dokładnie rozmazów, należy liczyć się z wynikami fałszywie dodatnimi (Floyd i wsp., 1983).
Izolacja wirusa
Izolacja wirusa w hodowli komórkowej uważana jest za ostateczne kryterium rozpoznania trwałej wiremii FeLV (Jarrett, 1980; Jarrett i wsp., 1982). Jednakże wprowadzenie bardziej nowoczesnych metod diagnostycznych (Hofmann-Lehmann i wsp., 2001) spowodowało, że rzadko wykorzystuje się ją w rutynowych badaniach.
PCR na obecność prowirusa (DNA)
Z uwagi na to, że każda kocia komórka zawiera od 12 do 15 kopii endogennego FeLV, początkowo trudno było ustalić, które sekwencje miałyby być swoiste dla wykrycia obecności prowirusa egzogennego (Jackson i wsp., 1996). Przydatność diagnostyczna technik PCR zwiększyła się znacznie dzięki wprowadzeniu wysoce swoistej ich modyfikacji – tzw. PCR w czasie rzeczywistym (real-time PCR), która pozwala nie tylko wykryć egzogennego prowirusa FeLV, ale również ocenić jego ilość (Hofmann-Lehmann i wsp., 2001; Tandon i wsp., 2005). Metody PCR mają najwyższą czułość i wysoką swoistość, pod warunkiem że są wykonywane w czystych, izolowanych pomieszczeniach, ze wszystkimi niezbędnymi kontrolami i z zachowaniem zasad „dobrej praktyki laboratoryjnej”. PCR na obecność prowirusa we krwi pełnej może być badaniem rozstrzygającym w przypadku wątpliwych wyników testów na antygen p27. Ponadto PCR z pełną krwią może być pomocny w bardzo wczesnej fazie zakażenia, gdyż wynik dodatni pojawia się wcześniej niż w testach na obecność antygenu p27 (Hofmann-Lehmann i wsp., 2006). Ponadto PCR można też wykorzystać w badaniach dużych skupisk kotów, aby potwierdzić, że są one wolne od FeLV, bądź też w wykrywaniu kotów zakażonych regresywnie (latentnie, czyli nosicieli prowirusa). Wreszcie może to być badanie przydatne u kotów z objawami typowymi dla trwałej wiremii FeLV, u których jednak nie wykryto antygenu p27.
RT-PCR na obecność wirusowego RNA
Wykrywanie wirusowego RNA poszerzyło możliwości rozpoznawania zakażenia FeLV (Tandon i wsp., 2005). RNA wirusa znajdujące się we krwi pełnej, surowicy, osoczu lub ślinie wykrywa się za pomocą odwrotnej transkryptazy (ang. reverse transcriptase – RT) techniką PCR (RT-PCR) w czasie rzeczywistym. Umożliwia to wykazanie obecności sekwencji genowych wirusa i określenie ich ilości bez konieczności używania hodowli komórkowych. RT-PCR wykrywająca RNA wirusa dostarcza inne informacje niż PCR na obecność DNA prowirusa. U wielu kotów, które przezwyciężyły wiremię FeLV, nadal można wykazać obecność prowirusa (zakażenie regresywne, czyli latentne), nie można jednak stwierdzić wirusowego RNA w osoczu, ślinie bądź kale (Gomes-Keller i wsp., 2006a).
Obecność wirusowego RNA w ślinie stanowi wiarygodny wskaźnik wiremii (Gomes-Keller i wsp., 2006b). Próbka śliny do zbadania, czy kot ma wiremię, jest alternatywą dla pobierania krwi, które wiąże się zwykle ze stresem pacjenta. Co więcej, pobranie śliny nie musi być przeprowadzone przez specjalnie przeszkolony personel.
Badanie osocza lub śliny za pomocą RT-PCR może być także przydatne w bardzo wczesnej fazie zakażenia, gdyż dodatni wynik pojawia się już tydzień po zakażeniu FeLV, a więc wcześniej niż w przypadku badania na antygen p27 i nieco wcześniej niż w badaniu PCR na obecność prowirusa we krwi (Hofmann-Lehmann i wsp., 2006; Cattori i wsp., 2009).
W większości przypadków badania pod kątem FeLV wykonuje się u pojedynczych kotów. RT-PCR można jednak przeprowadzić w próbce zbiorczej śliny, ponieważ test ten jest dostatecznie czuły, aby wykryć zakażenie u jednego kota w próbce zawierającej ślinę zmieszaną od 30 osobników. Może to być przydatne w badaniach przesiewowych wykonywanych w dużych grupach kotów (Gomes-Keller i wsp., 2006b).
Wykrywanie przeciwciał
Po zaobserwowaniu, że jedynym wskaźnikiem zakażenia FeLV może być wytworzenie przeciwciał (Major i wsp., 2010), sprawdzano przydatność diagnostyczną wielu różnych testów na obecność przeciwciał skierowanych przeciwko różnym antygenom. W przeciwieństwie do wcześniejszych wyników (Fontenot i wsp., 1992), rekombinowany antygen FeLV p15(E) okazał się bardzo przydatny do wykrywania przeciwciał wytwarzanych wskutek zakażenia FeLV (Boenzli i wsp., 2014).
Choć więc możliwe jest wykrycie przeciwciał przeciw różnym antygenom FeLV, wyniki takich badań są trudne do interpretacji, ponieważ niektóre koty wytwarzają przeciwciała przeciwko własnemu endogennemu FeLV. Z tego względu obecnie uznaje się, że przydatność diagnostyczna testów serologicznych jest niewielka, ewentualnie z wyjątkiem wykrywania p15E (Boenzli i wsp., 2014). Możliwe jest także oznaczenie miana przeciwciał neutralizujących FeLV, ale nie są one powszechnie dostępne (z wyjątkiem Wielkiej Brytanii), więc są rzadko stosowane.
W niektórych laboratoriach badawczych wykrywano przeciwciała przeciw tzw. antygenom FOCMA (feline oncornavirus-associated cell membrane antigen), które uchodziły za wskaźnik obecności nowotworu. Później wykazano, że FOCMA w istocie jest kombinacją kilku antygenów wirusa (Vedbrat i wsp., 1983). Z uwagi na to, że test ten jest trudny w wykonaniu i standaryzacji, uważa się, że nie jest on przydatny klinicznie.