Ocena przepływu krwi
Istnieje wiele metod pozwalających ocenić dopływ krwi do kończyny lub jego brak. Manualne wyczucie tętna może nie być dostatecznie miarodajnym wskaźnikiem ukrwienia z uwagi na to, że puls bywa trudny do wyczucia w każdej sytuacji, w której perfuzja jest zmniejszona (na przykład w przebiegu wstrząsu hipowolemicznego). Przepływ krwi w tętnicy można określić, przykładając głowicę ciśnieniomierza doplerowskiego do tętnicy grzbietowej stopy lub dłoniowej. Brak sygnału może wskazywać na brak przepływu krwi. Na dokładność tego badania wpływa też potencjalnie obniżenie perfuzji wywołane spadkiem ciśnienia krwi o innej przyczynie.
Kolejnym sposobem oceny prawidłowego ukrwienia jest pomiar stężenia glukozy lub mleczanów w chorej kończynie. Oznaczenia przeprowadza się we krwi pobranej z żyły odpiszczelowej i porównuje się je z wynikami badania biochemicznego surowicy uzyskanej z żyły szyjnej zewnętrznej. W niedokrwionej kończynie stężenie glukozy powinno być niższe, a mleczanów wyższe względem próbki pochodzącej z dużego naczynia żylnego. Badaniem dostarczającym najwięcej informacji na temat przepływu krwi jest angiografia, rzadko jednak stosuje się ją w praktyce i jedynie w niewielu przypadkach choroby zatorowo-zakrzepowej bywa naprawdę potrzebna.
Badania laboratoryjne
We wszystkich przypadkach należy zgromadzić podstawowe wiadomości o pacjencie, na które składają się: wyniki badania morfologicznego krwi, badania biochemicznego surowicy oraz ogólnego moczu. Parametry określone w badaniu morfologicznym krwi i ogólnym badaniu moczu pozostają zwykle w zakresie wartości referencyjnych.
Badanie biochemiczne surowicy wykazuje natomiast nierzadko takie odchylenia od normy jak hiperglikemia oraz podwyższona aktywność aminotransferazy alaninowej i asparaginianowej. Azotemia u kotów może natomiast wynikać z ograniczenia przepływu krwi przez nerki lub zaczopowania tętnicy nerkowej przez skrzeplinę. Z kolei hiperkaliemia bywa stwierdzana w momencie przyjęcia pacjenta lub rozwija się podczas leczenia z powodu współistniejącej martwicy niedokrwiennej nerki albo zespołu poreperfuzyjnego (jony potasu są wówczas uwalniane z niedokrwionych komórek mięśni szkieletowych). Wspomniana hiperpotasemia może być na tyle zaawansowana, że wymaga leczenia. Do innych zaburzeń występujących u kotów z chorobą zatorowo-zakrzepową należą: hipokalcemia, hiperfosfatemia, hipokaliemia oraz hiponatremia.2 Znacznie podwyższona bywa również aktywność kinazy keratynowej.28
W momencie przyjmowania pacjenta czas protrombinowy (PT) oraz czas częściowej tromboplastyny po aktywacji (APTT) są zwykle prawidłowe.9 Możliwe jest także oznaczanie stężenia D-dimerów (produktów rozpadu usieciowanej fibryny), ale wykazano jego podwyższenie jedynie w blisko 50% przypadków kotów z ATE.17 Jest to jednak badanie raczej nieswoiste, ponieważ poziom tych związków bywa również podwyższony w przebiegu zakrzepicy wywołanej innymi przyczynami (np. zespół rozsianego krzepnięcia wewnątrznaczyniowego, choroba nowotworowa, uszkodzenia wątroby, krwawienie).
Z uwagi na to, że występowanie choroby zatorowo-zakrzepowej zostało udokumentowane u kotów z nadczynnością tarczycy, wskazane może być u nich również wykonanie profilu tarczycowego w badaniu biochemicznym surowicy.2
Badanie radiograficzne
Nawet jeżeli w badaniu osłuchowym klatki piersiowej u pacjenta nie stwierdza się zmian, warto wykonać u niego badanie radiograficzne klatki piersiowej. W jednym z badań u 88% kotów z ATE wykazano powiększenie sylwetki serca.1 U pacjentów, u których dotychczas nie obserwowano żadnych niepokojących objawów, kardiomegalia może stanowić dowód współistniejącej choroby serca. W badaniu radiograficznym klatki piersiowej czasem obserwuje się u nich także cechy obrzęku płuc lub obecności płynu w jamie opłucnej bądź też uzyskuje się potwierdzenie występowania choroby nowotworowej płuc.
Badanie echokardiograficzne
Badanie echokardiograficzne serca ma ogromne znaczenie w ustaleniu, czy to właśnie choroba tego narządu stanowi przyczynę ATE. Może być ono również przydatne w wykazaniu tworzenia się dodatkowych zakrzepów u pacjenta. Czasami udaje się zaobserwować u niego skrzeplinę w lewym uszku lub przedsionku serca. Zgodnie z tym, co napisano we wcześniejszej części artykułu, u kotów z chorobą zatorowo-zakrzepową można stwierdzić występowanie zjawiska SEC, co wskazuje na zwiększone ryzyko powstania zakrzepu.
Przebieg hemostazy
Hemostaza składa się z trzech etapów: utworzenia czopu trombocytarnego (hemostaza pierwotna), stabilizacji czopu za pomocą sieci włókien fibryny (hemostaza wtórna) oraz jego rozpadu (fibrynolizy).
Hemostaza pierwotna
W warunkach prawidłowych płytki krwi przylegają do uszkodzonej warstwy podśródbłonkowej na zasadzie oddziaływania z wieloma ligandami i receptorami. Po związaniu się z miejscem uszkodzonego śródbłonka płytki krwi zmieniają swój kształt, ułatwiając proces agregacji, który prowadzi do ich aktywacji. Aktywacja płytek krwi wiąże się z wytworzeniem i uwolnieniem agonistów (takich jak adenozynodifosforan, serotonina, epinefryna, czynnik aktywujący trombocyty oraz tromboksan A2) z płytek krwi, które następnie przyciągają kolejne płytki i nasilają dalszą adhezję i aktywację.1
Do aktywacji płytek krwi może również dochodzić w obecności trombiny niezależnie od agregacji. Trombina jest czynnikiem silnie aktywującym płytki, a proces zapalny powoduje potencjalnie zwiększenie jej wytwarzania i wzrost ilości obecnej we krwi krążącej, co powoduje szeroko zakrojoną aktywację trombocytarną.2 Błony komórkowe aktywowanych płytek krwi stanowią wówczas szkielet, na którym gromadzą się czynniki krzepnięcia i dochodzi do przekształcenia fibrynogenu w fibrynę.1
Hemostaza wtórna
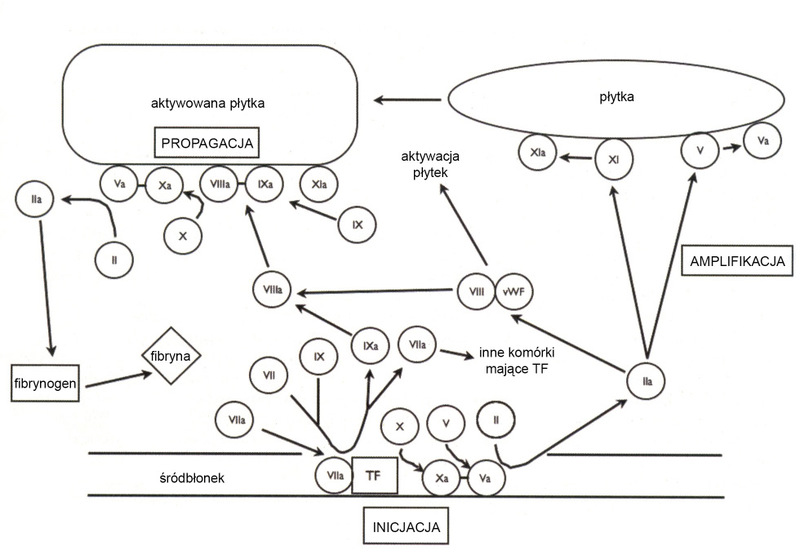
W przebiegu hemostazy wtórnej obserwuje się powstanie stabilnego skrzepu dzięki siatce fibryny. Odbywa się to w trzech fazach: inicjacji, amplifikacji i propagacji (patrz rycina).
Inicjacja polega na ekspozycji czynnika tkankowego na elementy krwi, do której dochodzi po uszkodzeniu śródbłonka. Obecny w krążeniu aktywny czynnik VII wiąże się z czynnikiem tkankowym, prowadząc w rezultacie do aktywacji wspólnej drogi krzepnięcia i wytworzenia niewielkiej ilości trombiny. Owa nieznaczna część powstałej wówczas trombiny może aktywować kolejne płytki oraz rozpocząć fazę amplifikacji.
W fazie amplifikacji następuje odłączenie czynnika von Willebranda od czynnika VIII i aktywacja czynników VIII, V oraz IX, prowadząca w końcu do nasilenia tworzenia trombiny.
W fazie propagacji dochodzi do przekształcenia fibrynogenu w fibrynę, co w dalszej części wpływa na czynnik XIII i prowadzi do powstania stabilnego skrzepu.2 Wiele z opisanych procesów zachodzi na powierzchni aktywowanej płytki krwi.
Fibrynoliza
Ostatnim elementem prawidłowej hemostazy jest rozpuszczenie sieci fibryny, nazywane fibrynolizą. Pod wpływem plazminy skrzep podlega rozpadowi. Do powstania plazminy dochodzi natomiast w wyniku przekształcenia plazminogenu w formę aktywną, co dzieje się za pośrednictwem aktywatorów plazminogenu, w tym tkankowego aktywatora plazminogenu i urokinazy. Tkankowy aktywator plazminogenu jest uwalniany z komórek śródbłonka w odpowiedzi na uszkodzenie lub obecność trombiny. Z kolei urokinaza wydaje się odgrywać większą rolę w procesie fibrynolizy pozanaczyniowej.
Do głównych czynników hamujących fibrynolizę należą: inhibitor aktywacji plazminogenu-1, który ma za zadanie blokować efekty działania tkankowego aktywatora plazminogenu, prowadzące do fibrynolizy, oraz aktywowany trombiną inhibitor fibrynolizy, uniemożliwiający przekształcanie plazminogenu do plazminy.3
PIŚMIENNICTWO
1. McMichael M. Primary hemostasis. J Vet Emerg Crit Care 2005;15(1):1-8.
2. Smith SA. The cell-based model of coagulation. J Vet Emerg Crit Care 2009;19(1): 3-10.
3. Hopper K, Bateman S. An updated view of hemostasis: mechanisms of hemostatic dysfunction associated with sepsis. J Vet Emerg Crit Care 2005;15(2):83-91.
Rozważania na temat początkowego leczenia
Często, zanim wdroży się swoiste leczenie w kierunku ATE, należy zapobiec zaburzeniom, które stanowią większe zagrożenie dla życia zwierzęcia.
Zastoinowa niewydolność serca
Początkowy etap intensywnej terapii polega najczęściej na leczeniu zastoinowej niewydolności serca (CHF – ang. congestive heart failure). Standardowo obejmuje ona tlenoterapię oraz podawanie furosemidu. U większości kotów obserwuje się zwiększenie liczby oddechów, nie zawsze jednak wiąże się to z występowaniem CHF. W jednym z badań przyspieszenie oddechów lub zianie stwierdzono u 88% kotów bez CHF.2 Prawdopodobnie dużą rolę w zwiększeniu liczby oddechów u pacjentów bez CHF odgrywa ból oraz niepokój. Przed rozpoczęciem leczenia należy wykonać zdjęcie rentgenowskie klatki piersiowej, aby potwierdzić cechy obrzęku płuc lub obecności płynu w jamie opłucnej, ponieważ diureza spowodowana podaniem furosemidu może pogorszyć przepływ krwi.
Zwalczanie bólu
Neuropatia niedokrwienna wywołana chorobą zatorowo-zakrzepową jest niezwykle bolesna, a zatem zwalczanie bólu stanowi priorytet w leczeniu pacjentów z ATE. Aby zapewnić skuteczną analgezję, u większości kotów niezbędne jest zastosowanie opioidów. Dobrym rozwiązaniem jest wówczas podanie hydromorfonu (0,1 mg/kg m.c. dożylnie co dwie do czterech godzin),29 buprenorfiny (0,02 mg/kg m.c. dożylnie co sześć do ośmiu godzin)30 lub fentanylu (bolus dożylny 2 do 3 µg/kg m.c., a następnie 2 do 3 µg/kg/godzinę w ciągłej infuzji dożylnej).31 Butorfanol (0,2-0,4 mg/kg dożylnie, domięśniowo lub podskórnie)32 ma minimalne działanie przeciwbólowe, umożliwia jednak uspokojenie i sedację zwierzęcia.
Płynoterapia